熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
研究表明,KATP通道開放劑如pinacidil可降低Cse-/--小鼠的血壓。為了確定Cse-/--小鼠中2,3-BPG生成和Hb-O2親和力的變化是否與高血壓相關,我們檢測了pinacidil處理對Cse-/--小鼠紅細胞中2,3-BPG生成和P50的影響。如圖2(d)–2(f)所示,pinacidil處理顯著降低了Cse-/--小鼠的血壓,但未影響其紅細胞中2,3-BPG的生成和Hb-O2親和力。上述數據表明,Cse-/--小鼠中2,3-BPG和P50水平的升高與高血壓無關。接下來,我們測試了硫化氫對野生型小鼠和人類紅細胞中2,3-BPG生成及血紅蛋白氧親和力的直接影響。如圖3(a)-3(c)所示,用硫化氫供體GYY4137(500μM)處理分離的小鼠紅細胞后,細胞內的2,3-BPG濃度降低,氧解離曲線左移,P50水平下降。在分離的人類紅細胞中也觀察到GYY4137對2,3-BPG生成和P50水平的類似影響(圖3(d)-3(f))。此外,我們發現GYY4137處理對小鼠和人類血紅蛋白的P50水平無顯著影響。上述數據表明,硫化氫通過作用于紅細胞而非血紅蛋白來降低2,3-BPG生成,從而增強血紅蛋白-氧親和力。

圖3:硫化氫對培養紅細胞中2,3-BPG濃度和Hb-O2親和力的影響。(a–c)分離的小鼠紅細胞經指定劑量的GYY4137處理6小時后收集,用于測定2,3-BPG水平(a)和氧解離曲線((b)P50值;(c)氧解離曲線的代表性軌跡)。數據以均值±標準誤表示(n=6個培養物)。(d–f)人紅細胞經GYY4137處理6小時后收集,用于測定2,3-BPG水平(d)和氧解離曲線((e)P50值;(f)氧解離曲線的代表性軌跡)。數據以均值±標準誤表示(n=6個培養物)。
3.2硫化氫通過抑制膜錨定的 BPGM 從膜到細胞質的釋放來抑制紅細胞2,3- BPG 的產生
硫化氫通過抑制膜錨定的BPGM從膜向細胞質的釋放來抑制紅細胞2,3-BPG生成。BPGM是紅細胞中2,3-BPG生成的關鍵限速酶。在紅細胞中,糖酵解酶在膜與細胞質之間的轉運是調控細胞質糖酵解酶活性的關鍵機制。我們發現與野生型小鼠相比,Cse-/-小鼠的細胞質中BPGM活性增加(圖4(a))。與此一致的是,Cse-/-小鼠的細胞質中BPGM蛋白水平也顯著升高,而膜中BPGM蛋白水平顯著降低(圖4(b))。免疫熒光分析還顯示BPGM從細胞膜向在Cse-/-小鼠紅細胞的胞質中(圖4(c)),GYY4137處理顯著降低了胞質BPGM的活性和蛋白水平,同時提高了Cse-/-小鼠細胞膜上的BPGM含量(圖4(a)和4(b)),并誘導BPGM在Cse-/-小鼠紅細胞膜上發生錨定(圖4(c))。在小鼠(圖5(a)和5(b))及人類(圖5(c)和5(d))紅細胞培養模型中,GYY4137同樣表現出抑制胞質BPGM活性、提升膜上BPGM水平、降低胞質BPGM水平的特性。圖像分析證實,GYY4137可誘導BPGM從胞質向細胞膜的轉位(圖5(e))。
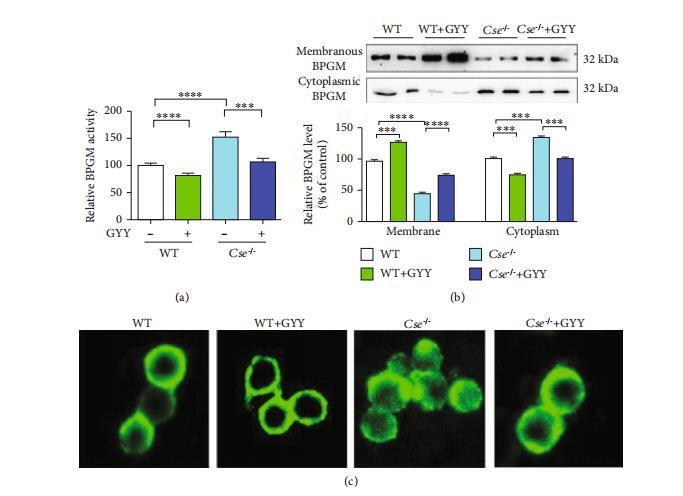
圖4:硫化氫對紅細胞膜與細胞質間BPGM轉運的影響。野生型(WT)和Cse-/-小鼠分別給予生理鹽水或GYY4137(50 mg/kg)。處理24小時后采集血樣。分離紅細胞以測定胞質BPGM活性及膜與胞質BPGM水平,并進行BPGM免疫熒光染色。(a)WT和Cse-/-小鼠紅細胞胞質BPGM活性(有無GYY4137處理)。數據以均值±標準誤表示(n=10)。(b)WT和Cse-/-小鼠紅細胞膜與胞質BPGM水平(有無GYY4137處理)。數據以均值±標準誤表示(n=6)。(c)WT和Cse-/-小鼠紅細胞BPGM染色代表性圖像(有無GYY4137處理)。***p<0.001,*****p<0.0001
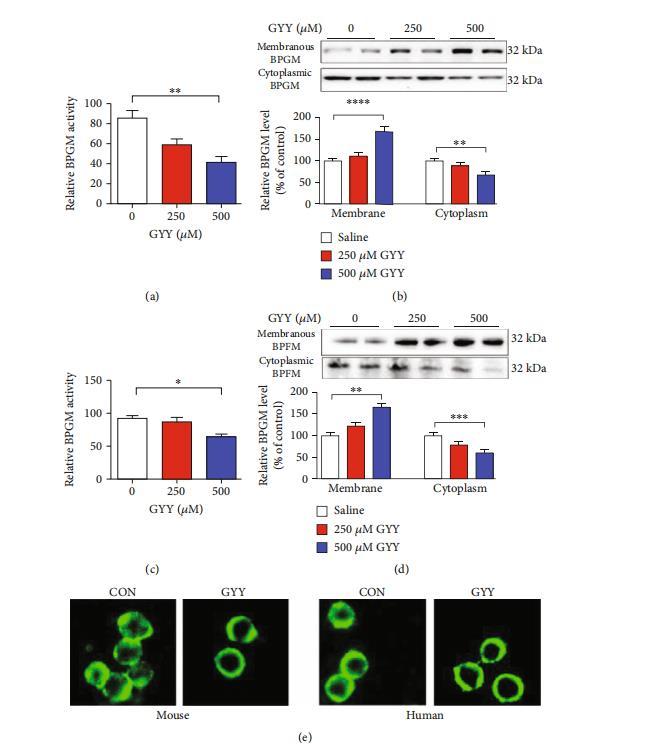
圖5:硫化氫對培養紅細胞膜與細胞質間BPGM轉運的影響。紅細胞分別從野生型小鼠(a、b、e)和健康志愿者(c、d、e)中分離,并與指定劑量的GYY4137共同孵育6小時。收集細胞以測定胞質BPGM活性、膜與胞質BPGM水平,并進行BPGM免疫熒光染色。(a、c)小鼠(a)和人(c)紅細胞經GYY4137處理前后胞質BPGM活性。(b、d)小鼠(b)和人(d)紅細胞經GYY4137處理前后膜與胞質BPGM水平。(e)小鼠和人紅細胞經GYY4137處理前后染色的代表性圖像。數據以均值±標準誤表示(n=6個培養物)。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
3.3.硫化氫降低血紅蛋白與膜的錨定,從而減少BPGM從膜的釋放。
已有研究表明,糖酵解酶在膜與細胞質之間的轉運歸因于血紅蛋白在膜與細胞質之間的運輸。血紅蛋白可結合膜上的帶3細胞質結構域并取代糖酵解酶,這些分子隨后重新定位到細胞質中。因此我們假設,H2S誘導的BPGM與膜的錨定歸因于膜錨定血紅蛋白的減少。為驗證這一假設,我們首先探究了BPGM是否與紅細胞膜蛋白相互作用。質譜分析顯示,α-和β-譜蛋白、錨蛋白及帶4.2蛋白是與BPGM相互作用的潛在蛋白。有趣的是,在紅細胞膜中,帶3蛋白可與多種蛋白相互作用,包括帶4.2、錨蛋白和譜蛋白,從而構成稱為帶3巨復合體的單一復合物。通過共免疫沉淀法,我們驗證了BPGM可與帶4.2相互作用,并確認血紅蛋白與帶4.2相互作用(圖6(a))。

圖6:硫化氫對紅細胞中Hb和BPGM與膜蛋白相互作用及Hb轉運的影響。(a)Hb和BPGM與band 4.2蛋白的相互作用。在小鼠紅細胞裂解液中進行band 4.2抗體共免疫沉淀。通過Western blot分析檢測免疫沉淀物中的BPGM和Hb。(b)硫化氫對體內Hb在膜與細胞質間轉運的影響。野生型和Cse-/-小鼠分別給予生理鹽水或GYY4137(50 mg/kg)。處理24小時后收集紅細胞以測定膜血紅素濃度。數據以均值±標準誤表示(n=10)。(c,d)硫化氫對培養紅細胞中Hb在膜與細胞質間轉運的影響。分離的小鼠(c)或人(d)紅細胞經指定劑量GYY4137處理6小時后收集,以測定膜血紅素濃度。數據以均值±標準誤表示(n=6個培養物)。(e)代表性圖像顯示硫化氫對Hb和BPGM與band 4.2蛋白相互作用的影響。野生型和Cse-/-小鼠分別注射生理鹽水或GYY4137(50 mg/kg)。處理24小時后采集血液樣本。分離紅細胞進行共免疫沉淀分析。*p<0.05,**p<0.01,***p<0.001。
因此,這可能表明血紅蛋白和BPGM通過與帶3巨復合體相互作用而錨定于膜。其次,我們通過測量紅細胞膜中的血紅素含量來確定膜錨定血紅蛋白。根據Cse-/-小鼠中BPGM從細胞膜釋放的實驗結果,Cse-/-小鼠紅細胞的膜血紅素含量顯著升高,但經GYY4137處理后該現象得到逆轉(圖6(b))。在小鼠和人類紅細胞培養實驗中,GYY4137處理同樣降低了膜血紅素含量(圖6(c)和6(d))。進一步研究發現,Cse-/-小鼠紅細胞中,帶4.2蛋白與血紅蛋白(Hb)的結合量增加,而與BPGM的結合量減少。GYY4137處理后,帶4.2蛋白與Hb的結合量下降,同時與BPGM的結合量有所增加。
在Cse-/-小鼠的紅細胞中,硫化氫與BPGM結合(圖6(e)),表明帶4.2與BPGM的結合以及帶4.2與Hb的結合是相互關聯的,且硫化氫對Hb和BPGM與帶3大復合體的結合有影響。血影膜實驗顯示,GYY4137減少了小鼠(圖7(a)和7(b))和人類(圖7(c)和7(d))紅細胞血影膜制備中膜的血紅素含量和上清液中的BPGM活性。因此,我們提供了證據表明,BPGM從膜的釋放與Hb錨定到膜有關,并且硫化氫負向調節這一過程。
3.4 硫化氫抑制Hb錨定到膜可能與Hb的S-硫水合作用有關。
S-硫水合作用已被認為是真核細胞中硫化氫的一種新型翻譯后修飾。S-硫水合作用的抑制劑異乙酰胺(IAM)逆轉了GYY4137誘導的膜中血紅素含量和細胞質中BPGM活性的減少(圖7(a)–7(d)),表明S-硫水合作用可能是H2S介導的Hb和BPGM在膜與細胞質之間的轉運的基礎。接下來,我們打算通過馬來酰亞胺實驗結合質譜分析來鑒定硫化氫在紅細胞中硫水合的蛋白質。我們發現Hb是小鼠紅細胞中S-硫水合蛋白質中最豐富的蛋白質。如圖7(e)所示,與野生型小鼠相比,Cse-/-小鼠紅細胞中Hb的S-硫水合作用較少。給予GYY4137可使Cse-/-和野生型小鼠的血紅蛋白(Hb)發生S-硫水合。在培養的人類紅細胞中,GYY4137處理同樣增強了Hb的S-硫水合(圖7(g))。然而,在野生型和Cse-/-小鼠的紅細胞中,無論是否使用GYY4137處理,均未觀察到明顯的BPGM S-硫水合現象(圖7(f))。在培養的人類紅細胞中,無論是否使用GYY4137,均未出現明顯的BPGM S-硫水合(圖7(h))。隨后我們試圖確定Hb的S-硫水合位點。質譜分析顯示,在小鼠紅細胞中,Hbα鏈第104位半胱氨酸的單一位點發生S-硫水合。而在人類紅細胞中,Hbα鏈第105位半胱氨酸發生S-硫水合。
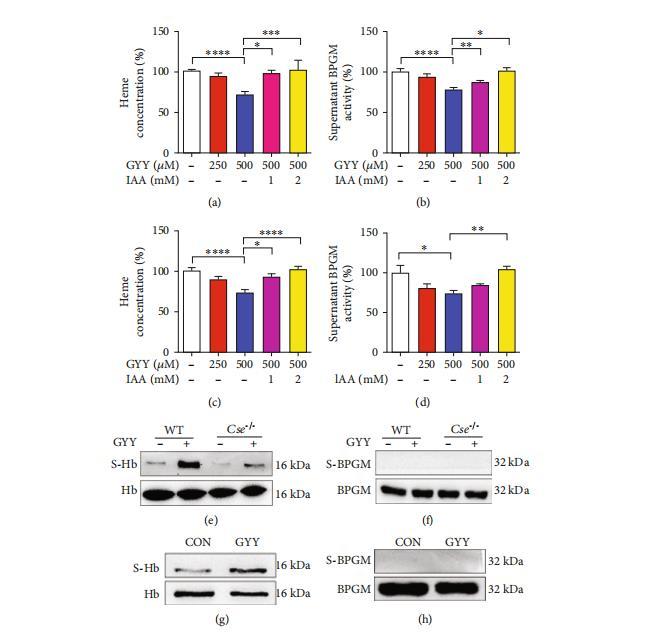
圖7:硫化氫對Hb和BPGM轉運的調節作用及S-硫水合在這些過程中的作用。(a–d)硫化氫和碘乙酰胺對小鼠和人紅細胞鬼膜中Hb與膜結合及BPGM從膜釋放的影響。小鼠紅細胞膜鬼膜經Hb和不同濃度的GYY4137處理(存在或不存在碘乙酰胺(IAM))后,Hb與膜結合(a)和BPGM從膜釋放到細胞質(b)。人紅細胞膜鬼膜經Hb和不同濃度的GYY4137處理(存在或不存在碘乙酰胺(IAM))后,Hb與膜結合(c)和BPGM從膜釋放到細胞質(d)。數據以均值±標準誤表示(n=8)。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。(e,f)野生型和Cse-/-小鼠紅細胞中Hb和BPGM S-硫水合的代表性圖像。野生型和Cse-/-小鼠分別給予生理鹽水或GYY4137(50 mg/kg)。治療24小時后采集血樣。使用生物素開關技術分離紅細胞,以測定Hb(e)和BPGM(f)的S-硫水合。(g,h)培養人紅細胞中Hb和BPGM S-硫水合的代表性圖像。分離的人紅細胞經GYY4137(500μM)處理6小時后,收集用于測定Hb(g)和BPGM(h)的S-硫水合。
 相關新聞
相關新聞