熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
2.3.Msdo變體的表達和純化
首先,在30°C和120 rpm旋轉搖床中,在20 ml含抗生素的LB中培養含有相應質粒的大腸桿菌BL21(DE3)pLysS菌株約18小時。然后,用0.5 ml相應預培養物接種50 ml體積的也含有這些抗生素的LB主培養物,并在30°C和120 rpm下培養直至600 nm光密度達到0.6-0.8。通過添加終濃度為400μM的異丙基-β-D-硫代半乳糖苷并在25°C搖床上再培養20小時實現表達誘導。通過在4°C和9000 rpm下離心20分鐘收獲細胞。收獲細胞后,獲得的沉淀在-20°C儲存直至進一步使用,或立即通過添加2 ml結合緩沖液和少量DNase進行處理。通過French Press在10,000 MPa下通過2-3次通道進行細胞破碎。對于蛋白質純化,粗提物在4°C下以15,000g離心15分鐘。獲得的上清液進行鎳-硝基三乙酸親和層析,應用His SpinTrap柱按照制造商說明進行。洗滌緩沖液含有50 mM Tris/HCl pH 7.4、500 mM NaCl和40 mM咪唑;洗脫緩沖液由50 mM Tris/HCl pH 7.4、500 mM NaCl和500 mM咪唑組成。純化的酶直接用于實驗或在冰浴中儲存直至使用。通過SDS-PAGE監測純化。根據Bradford方法測定蛋白質濃度。
2.4.分析尺寸排阻色譜
為了確定不同酶變體與野生型Msdo相比的分子量,在Superdex 200 HP 16/600柱上進行分析尺寸排阻色譜。柱子用含有150 mM氯化鈉的50 mM磷酸鈉緩沖液(pH 7.4)平衡。使用凝膠過濾校準試劑盒低分子量按照制造商說明進行校準。將4 mg Ni-NTA純化的野生型酶上樣到柱上,以1 ml/min流速操作。監測280 nm吸光度以檢測相應蛋白質。
2.5.應用Ellman試劑的酶測定
作為定性酶測定,最終體積為1 ml的樣品含有50 mM Tris/HCl(pH 7.4)、25μM MS(DL-巰基琥珀酸)和4μg/ml相應酶,在25°C下在比色皿中孵育30分鐘。然后,添加Ellman試劑5,5'-二硫雙(2-硝基苯甲酸)至終濃度0.2 mM。DTNB與MS的游離巰基反應,釋放黃色2-硝基-5-硫代苯甲酸,可在412 nm測量。
2.6.應用氧電極測量的定量酶測定
對于定量測定,使用連接PicoLog數據記錄器和PicoLog記錄器軟件的氧電極Dual Digital Model 20。通過將所用緩沖液的氧濃度設為100%并使用含有0.1 M NaOH和0.1 M抗壞血酸的溶液確定缺氧條件來校準電極。此外,最大信號強度與相應溫度下可溶氧最大值(25°C時為0.2409μmol/ml)相等。通過水浴、浸入式加熱器帶溫度傳感器和蠕動泵保持測量裝置中溫度恒定。酶活性測定測量在含有不同底物濃度(0.05 mM-150 mM)的緩沖液(50 mM Tris/HCl,pH 7.4)中進行,通過添加酶啟動反應。作為對照,進行無酶和變性酶(95°C 10分鐘)的測量。使用Microsoft Excel分析所得數據,同時使用Excel的Solver加載項計算非線性回歸。
3.結果
為了進一步了解Msdo酶活性可能重要的氨基酸殘基,對野生型酶以及本研究中生成的七種酶變體(MsdoQ64A、MsdoR66A、MsdoH93L、MsdoH95L、MsdoC100S、MsdoH163L和MsdoY165F)進行了酶活性和動力學測定。所有七種變體均成功表達為可溶性蛋白并純化。然而,突變酶C100S的可溶性蛋白產量顯著較低。關于野生型酶的大小,早期研究中觀察到的二聚體結構得到確認。由于與先前研究使用的技術設備不同且為了更好的可比性,還記錄了野生型Msdo的動力學數據(圖3A)。在25°C下,計算得到表觀Km值為0.06 mM,比酶活性(Vmax)為14.68μmol min?1mg?1,kcat為5.61 s?1。
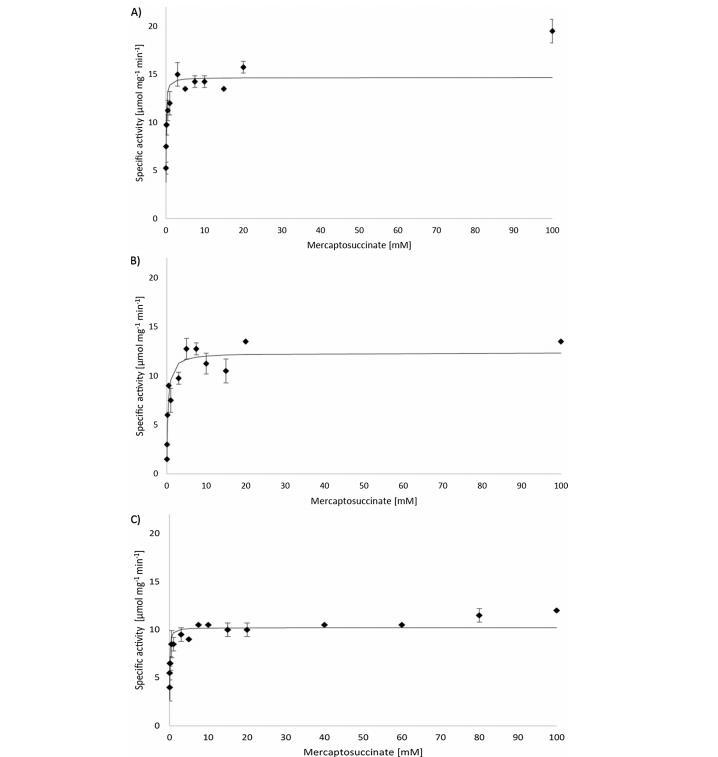
3.1.變體MsdoH93L、MsdoH95L、MsdoH163L和MsdoC100S
當將His93、His95和His163替換為亮氨酸時,對蛋白質三級結構的影響應盡可能小,觀察到的酶動力學數據變化應歸因于側鏈功能基團的丟失而非蛋白質結構的丟失。出于相同原因,C100被絲氨酸取代,從而將半胱氨酸的巰基變為羥基。使用Ellman試劑的定性酶測定顯示MsdoH93L、MsdoH95L、MsdoH163L和MsdoC100S無活性。此外,這些變體與亞鐵離子預孵育未產生任何積極效果(數據未顯示)。此外,當用氧電極測量活性時,無法確定這些變體的動力學數據。因此,未進行進一步表征。
3.2.MsdoQ64A的動力學數據
將Q64替換為丙氨酸是為了通過使用側鏈無任何功能基團的氨基酸來禁用任何共價鍵形成,從而將Msdo歸類為Arg型或Gln型Cdo同源物。對于變體MsdoQ64A,測定比酶活性(Vmax)為12.36μmol min?1mg?1,表觀Km值為0.29 mM,kcat為4.79 s?1(圖3B)。相對于野生型酶,MsdoQ64A仍表現出約84%的比活性。
3.3.變體MsdoR66A
出于與MsdoQ64A相同的原因進行酶變體MsdoR66A。在定性預測試中,僅檢測到MsdoR66A的酶活性非常低,這通過氧電極進一步檢查(數據未顯示)。至少需要應用38μg/ml的酶進行測量才能觀察到酶活性。由于這些高量,未確定動力學數據。
 相關新聞
相關新聞