熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
摘要:
嗎啡耐受性的產生和維持與神經炎癥和中樞谷氨酸能系統的功能障礙(如谷氨酸轉運體的硝化)有關。最近的證據表明,氫氣可以降低神經炎癥和氧化應激的水平,但其在嗎啡耐受中的作用尚未得到研究。大鼠經皮下注射嗎啡(每次10μg/10μL,每天兩次,共5天)。腹腔注射富氫鹽水(HS)或生理鹽水,劑量分別為1、3和10mL/kg,每次注射嗎啡前10分鐘注射。在注射嗎啡前一天(基線)和注射嗎啡期間的最多5天內,每天對尾彈潛伏期、機械閾值和熱潛伏期進行評估。促炎細胞因子[腫瘤壞死因子-α(TNF-α)、白細胞介素-1β(IL-1β)、IL-6]的表達(免疫印跡法)、星形膠質細胞的活化(免疫熒光法和免疫印跡法)、谷氨酸轉氨酶的硝酸化(免疫熒光法和免疫印跡法)和谷氨酸轉氨酶的硝酸化(免疫熒光法和免疫印跡法)、通過免疫沉淀、N-甲基-D-天冬氨酸(NMDA)受體NR1和NR2B亞基的膜和總表達。慢性嗎啡給藥誘導抗痛覺耐受,同時導致TNF-α、IL-1β和IL-6表達增加、星形膠質細胞活化、GLT-1和GS硝化、NR1和NR2B膜和總表達增加。注射HS可減輕嗎啡耐受性,其劑量與嗎啡耐受性呈劑量依賴性。
引言:
嗎啡等阿片類藥物仍被視為治療嚴重急性疼痛和慢性劇烈疼痛的最有效鎮痛藥。阿片類藥物耐受性是指阿片類藥物引起的疼痛緩解效果迅速下降的一種現象,在反復使用后會迅速發展。當出現這種耐受性時,需要使用更大劑量的阿片類藥物才能緩解同等程度的疼痛,但增加劑量會導致一些不良副作用,包括呼吸抑制、便秘、頭暈等,并極有可能導致成癮。因此,找出嗎啡耐受性的潛在分子機制非常重要。此外,還需要采取治療措施,在重復給藥后維持阿片類藥物的療效,同時不誘發耐受性或嚴重的副作用。先前的研究表明,長期嗎啡給藥增加了脊髓中小膠質細胞活動標志物OX-42和星形膠質膠質細胞活性標志物膠質纖維酸性蛋白(GFAP)的表達。此外,腫瘤壞死因子-α(TNF-α)、白細胞介素-1β(IL-1β)和白細胞介素-6(IL-6)等促炎細胞因子的釋放也有所增加。應用神經膠質代謝抑制劑可減輕嗎啡耐受性,提示小膠質細胞和星形膠質細胞的活化與嗎啡誘導的痛覺減退和耐受性有關。如何安全有效地抑制小膠質細胞和星形膠質細胞的活化以及長期嗎啡給藥誘導的促炎細胞因子的釋放,從而抑制嗎啡耐受,是一個亟待解決的問題。
谷氨酸在突觸間隙的過度積累是中樞敏化的主要原因,會導致痛覺減退和嗎啡耐受。細胞外谷氨酸水平的穩定性受到谷氨酸轉運體-1(GLT-1)的嚴格調控。在星形膠質細胞中,谷氨酰胺合成酶(GS)將興奮性谷氨酸轉化為谷氨酰胺,并證明GLT和GS的酪氨酸硝化可降低谷氨酸的轉運能力。然而,通過使用過氧化亞硝酸鹽分解催化劑,谷氨酸轉運能力下降的情況可以得到明顯改善。分解催化劑是一種人工合成物質,具有一定的副作用,因此無任何副作用的分解催化劑被認為是一種安全的替代品,具有更大的應用前景。
N-甲基-D-天冬氨酸(NMDA)受體在突觸可塑性和慢性疼痛形成中發揮著重要作用。一些報道證實,反復注射嗎啡會增加脊髓NMDA受體的表達。服用NMDA受體拮抗劑也能抑制嗎啡耐受性。然而,含有NR2B亞基的NMDA受體的遷移和NMDA受體的功能變化是否與嗎啡耐受有關,尚未得到充分解釋。
最近的一些研究表明,分子氫通過選擇性地減少羥自由基和過氧亞硝酸來發揮抗氧化作用、抗炎和抗細胞凋亡作用,并能有效預防多種疾病,如神經性疼痛、缺血性中風、腦損傷、敗血癥引起的認知功能障礙等。然而,目前還沒有證據表明氫氣對嗎啡耐受性是否有預防或治療作用。
因此,本研究旨在探討嗎啡耐受性形成過程中炎性細胞因子、GLT-1、GS硝化和NMDA受體販運的釋放。特別是驗證了腹腔注射富氫鹽水能否以劑量依賴的方式緩解嗎啡重復給藥引起的抗痛作用減弱。此外,在富氫鹽水的干預下,脊髓背角神經膠質的激活、GLT-1的表達、GS的硝化、谷氨酸的濃度、NR1、NR2B的表達和轉運均得到了檢測。本研究旨在探討富氫生理鹽水(HS)能否通過抑制神經膠質細胞活化、調節谷氨酸轉運體和受體的表達及功能來緩解嗎啡耐受性的發展。因此,富氫鹽水可能是抑制嗎啡耐受性形成的一種潛在治療方法。
材料與方法:
道德規范聲明:
本實驗方案經天津醫科大學動物關懷委員會批準,按照《神經科學研究中人與動物的使用政策》進行。實驗方案經天津醫科大學總醫院動物實驗倫理委員會批準。我們盡了最大努力減少動物的痛苦。
實驗動物:
成年雄性大鼠(體重250±280g)在藥物治療或手術前至少1周從中國人民解放軍軍事醫學科學院實驗動物中心獲得。大鼠在溫度(22±2℃)和濕度(55±10%)條件下飼養(一籠四只),12小時光/暗循環。大鼠可自由獲得食物和水。
外科手術:
按照Yaksh等人所述的方法,通過枕骨大孔為每只動物植入一根聚乙烯導管。使用七氟醚(3%)對大鼠進行深度麻醉,然后經寰枕膜植入8.0厘米長的聚乙烯(PE-10)導管。導管的一端到達脊髓的腰部膨大處,導管的另一端外露并固定。有神經功能障礙的大鼠被排除在進一步的實驗之外,并被吸入二氧化碳安樂死。
實驗方案:
手術后恢復7天后,大鼠被隨機分為7組(n=8):無知覺組(N):未接受任何治療;藥物組(V):嗎啡組(M):給大鼠腹腔注射嗎啡(每次10μg/10μl,每天兩次,8:00和20:00),共5天;富氫生理鹽水組(HS):給大鼠腹腔注射嗎啡(每次10μg/10μl,每天兩次,8:00和20:00),共5天:M+HS組:在注射嗎啡前10分鐘腹腔注射不同劑量的HS(1、3和10mL/kg),每天兩次,共5天。每次注射嗎啡或HS前15分鐘注射DHK(10毫克/千克,靜脈注射)、頭孢曲松(200毫克/千克,靜脈注射)。在基線(-1d)和干預后的1、2、3、4和5天測試疼痛水平。最后一次行為測試后,收集脊髓L4,6節段,如下圖所示:
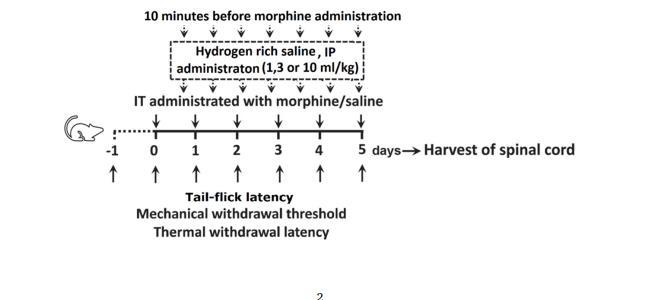
行為測試:
所有測試均以盲法進行。在進行行為測試前,所有大鼠都要在測試環境中飼養2天。
甩尾延遲:
抗痛覺效應通過熱水浸泡甩尾潛伏試驗(52.5℃)進行測量。為防止組織損傷,截止時間設定為10秒。在輸注藥物前和開始輸注藥物后的5天內,每天檢查甩尾反應。甩尾潛伏期重復三次,測試時間為10分鐘。潛伏期用公式換算成最大效應百分比(MPE):
爪子牽拉機械閾值(PWT):
PWT是通過后爪對vonFrey燈絲的牽拉反應進行評估的。使用vonFrey燈絲,用足夠的力使燈絲垂直于后爪,持續6?8秒,使其輕微彎曲,每次刺激間隔5分鐘。為防止組織損傷,使用的截止壓力為60g。
爪子抽出熱潛伏期(PWL):
將大鼠放在56℃的熱板上測量熱痛閾,截止時間為30秒,以防止組織損傷。
爪子抽出、搖晃和舔舐都顯示出積極的反應。PWT或PWL的平均值取自三次試驗的平均值。
制備富氫鹽水(HS):
氫氣的制備方法如之前的研究所述。簡而言之,在正常生理鹽水中高壓(0.4兆帕)溶解氫氣6小時,直至達到過飽和水平。經伽馬射線滅菌后,將氫氣儲存在鋁袋中,在4℃常壓下保持氫氣濃度高于0.6mmol/L。平均氫含量為0.85mmol/L。
測量血液中的氫濃度:
在注射HS前5分鐘和注射后5、10、15、20、30和45分鐘采集動脈和靜脈血樣本。使用針式氫電極(UnisenseA/S,丹麥奧胡斯)測量動脈和靜脈中的氫氣濃度。分別在注射HS前5分鐘和注射HS后5、10、15、20、30和45分鐘采集動脈血和靜脈血。
免疫熒光:
用3%七氟醚麻醉大鼠后,經升主動脈向所有大鼠灌注60mL肝素化生理鹽水(1000U/mL)。然后取出L4-6脊髓樣本,冷凍切片(6μm)并在0.5%牛血清白蛋白(BSA)和0.3%TritonX-100磷酸鹽緩沖鹽水(PBS)中孵育1小時,然后廣泛沖洗。然后,用兔抗GFAP在4℃下孵育切片過夜。第二天加入FITC結合的二抗。加入蓋玻片,隨后對玻片成像。使用ImageJ軟件對熒光強度進行量化。
谷氨酸濃度測量:
將L4-6脊髓樣本在100μL分析緩沖液中均質化,然后在13,000g轉速下離心10分鐘。按照谷氨酸比色分析試劑盒的說明,將分析試劑加入上清液中,在微孔板閱讀器上以450納米波長測量光密度(OD)。同時根據制造商的說明計算谷氨酸濃度。
免疫沉淀和免疫印跡:
將L4-6脊髓樣本在裂解緩沖液中均質,然后在4℃下以15,000rpm離心10分鐘。取出上清液作為總蛋白,用于檢測促炎細胞因子、GFAP和tNR1、tNR2B的表達水平。使用膜區蛋白質提取試劑盒。蛋白質樣品在95℃下煮沸,然后在10%SDS-PAGE凝膠上分離。簡而言之,PVDF膜經阻斷后與TNF-α、IL-1β和IL-6、表皮生長因子受體、mNR1、mNR2B、tNR1、tNR2B和β-肌動蛋白過夜。用相對二抗孵育膜,并用增強化學發光(ECL)溶液顯色。使用QuantityOne分析軟件對特定條帶的密度進行量化。結果以表皮生長因子受體或β-肌動蛋白免疫反應的百分比表示。
收集的組織的蛋白質硝化檢測方法如前所述。用放射免疫沉淀法(RIPA)緩沖液稀釋蛋白至200μg/100μL,然后與瓊脂糖結合的抗硝基酪氨酸抗體在4℃下孵育過夜。然后通過以12,000rpm離心30秒收集瓊脂糖珠,然后在RIPA緩沖液中洗滌3次。上清液在95℃下煮沸,用8%SDS-PAGE凝膠分離蛋白質。用多克隆抗GLT-1、GS一抗阻斷PVDF膜過夜。其余步驟如上所述。
統計分析:
所有數據均以平均值±標準差(SD)表示。數據統計分析采用SPSS18.0軟件。
抗痛覺試驗數據采用重復測量的雙向方差分析,然后進行事后比較。Western印跡結果、氫濃度、谷氨酸濃度和免疫熒光的測量采用單因素方差分析,并進行事后比較。P值小于0.05視為具有統計學意義。
氫氣電極研究硫化氫預處理、注射富氫鹽水能否抑制嗎啡耐受性形成(一)
 相關新聞
相關新聞