熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
2.實驗部分
2.1材料與表面制備方法
將2B表面光潔度的AISI 316冷軋不銹鋼板(X5CrNiMo17-12-2)切割成25.4x25.4毫米(1x1英寸)大小的載體。CLSM和pH監(jiān)測測量使用25x75毫米的載體尺寸。AISI 316載體在Elplatek A/S Galvanord的商業(yè)化改性銅銀浴中,以4 A dm?2的電流電鍍1分鐘。在電鍍過程之前,樣品進(jìn)行陰極脫脂(3±0.5 V,2分鐘),用去離子水沖洗,并在Wood's鎳沖擊液(4.5±0.5 A dm?2,2分鐘)中進(jìn)行表面活化。銅銀合金涂層和未涂層的AISI 316載體分別用作測試載體和對照載體。
2.2銅合金表面作為消毒劑的功效
測試根據(jù)美國環(huán)保署(US EPA)批準(zhǔn)的"銅合金表面作為消毒劑的功效測試方法"中報告的指南進(jìn)行,并采用良好實驗室規(guī)范(GLP)。在測試前一天,每種材料和微生物的五個載體用70%異丙醇清潔,用去離子水沖洗,并風(fēng)干。干熱滅菌后,每個載體放入單獨的sterile塑料培養(yǎng)皿中。根據(jù)方案指南,每個微生物使用六個不銹鋼和三個銅銀涂層載體進(jìn)行載體存活率、載體定量、中和劑無菌性、中和劑確認(rèn)和載體無菌性對照。每個測試的測試對照平行進(jìn)行。金黃色葡萄球菌ATCC 6538、耐甲氧西林金黃色葡萄球菌(MRSA)ATCC 33592、產(chǎn)氣腸桿菌ATCC 13048和銅綠假單胞菌ATCC 15442從-80°C儲備培養(yǎng)物中復(fù)蘇,劃線接種于胰蛋白胨大豆瓊脂(TSA)(Oxoid CM0131)上,在36±1°C(產(chǎn)氣腸桿菌為27±2°C)培養(yǎng)24小時。選取菌落轉(zhuǎn)移到1 mL胰蛋白胨大豆肉湯(TSB)(Oxoid CM0129)中,在36±1°C(產(chǎn)氣腸桿菌為27±2°C)培養(yǎng)24±2小時。將兩滿環(huán)(10μL)培養(yǎng)物轉(zhuǎn)移到10 mL TSB中,在36±1°C(產(chǎn)氣腸桿菌為27±2°C)培養(yǎng)24±2小時。此步驟重復(fù)三次。將4.7 mL細(xì)菌懸浮液轉(zhuǎn)移至新管中,加入0.25 mL熱滅活胎牛血清(FBS,Sigma F2442)和0.05 mL Triton X-100(Sigma-Aldrich),以產(chǎn)生5%FBS和0.01%Triton X-100的有機(jī)負(fù)載。將0.02 mL接種物涂布在載體上,距離載體邊緣約1/8英寸(≈3毫米)內(nèi),并在無菌工作臺中干燥約20分鐘。實驗期間記錄相對濕度為25%,實驗室溫度為23±2°C。120分鐘后,將載體轉(zhuǎn)移到含有20 mL中和劑溶液(改良Leetheen肉湯:Leetheen肉湯+0.07%卵磷脂+0.5%Tween 80)的單獨管中。將管子超聲處理5分鐘(28 kHz)(Delta 220;Deltasonic,Meaux,France)并旋轉(zhuǎn)以收集細(xì)菌。在磷酸鹽緩沖鹽水(PBS)(Oxoid BR0014G)中進(jìn)行10?1至10??系列稀釋,并取1 mL在TSA平板上平行涂布兩次。將平板置于無菌工作臺中,皿蓋微開以便在于36±1°C(產(chǎn)氣腸桿菌為27±2°C)培養(yǎng)48小時前干燥。使用菌落數(shù)在5-300范圍內(nèi)的平板進(jìn)行評估。每載體的CFU計算為相應(yīng)稀釋度下每個平板的平均菌落數(shù),乘以稀釋因子和中和溶液的體積,再除以涂布體積。報告對照和測試載體上存活微生物數(shù)量的幾何平均數(shù),并用于計算減少百分比。還根據(jù)EPA方案指南測試了MRSA ATCC 33592對苯唑西林的抗菌敏感性。金黃色葡萄球菌ATCC 25923用作對照微生物,抑菌圈根據(jù)臨床和實驗室標(biāo)準(zhǔn)協(xié)會的指南進(jìn)行判讀。
2.3銅合金表面細(xì)菌污染的持續(xù)減少
測試根據(jù)美國環(huán)保署(US EPA)批準(zhǔn)的"銅合金表面細(xì)菌污染持續(xù)減少測試方法"中報告的指南進(jìn)行,并采用良好實驗室規(guī)范(GLP)。測試程序按照前面部分概述進(jìn)行,每個時間點每個微生物使用五個重復(fù)。載體(每個微生物25個銅銀涂層測試載體,15個不銹鋼對照載體,16個不銹鋼載體用于定量和存活率對照)在"0時"接種5μL接種物,并在無菌條件下風(fēng)干。在初始接種后2、6、12、18和24小時,分別回收五個銅銀電鍍載體、三個不銹鋼對照載體和三個用于定量對照的不銹鋼載體。這些載體分別接種一次、兩次、四次、六次和八次。剩余的載體分別在3、6、9、12、15、18和21小時后重新接種5μL接種物。回收的載體轉(zhuǎn)移到含有20 mL中和劑溶液的單獨50 mL離心管中,超聲處理5分鐘(28 kHz)(Delta 220;Deltasonic,Meaux,France)并旋轉(zhuǎn)混勻。在PBS中進(jìn)行系列稀釋(10?1-10??),并取1 mL在TSA平板上平行涂布兩次。干燥后,平板在36±1°C(產(chǎn)氣腸桿菌為27±2°C)培養(yǎng)48小時。計算中使用菌落數(shù)在5-300范圍內(nèi)的平板。
2.4改良活/死染色測定和CLSM
使用含有0.2%SYTO 9綠色熒光核酸染料(Invitrogen,USA)和0.2%SYTOX AADvanced死細(xì)胞染料(Invitrogen,USA)的改良活/死染料混合物(溶于MilliQ水)來可視化和跟蹤與銅銀合金涂層表面接觸的細(xì)菌膜的殺滅過程。SYTO 9可以穿透完整(活細(xì)胞)和受損(死細(xì)胞)的膜,而SYTOX AADvanced只染色受損細(xì)胞。改良的染料混合物旨在允許直接檢查銅銀合金涂層基底上的細(xì)菌細(xì)胞。發(fā)現(xiàn)銅表面會干擾和吸收碘化丙啶(常用的死細(xì)胞染料)的熒光信號。這種效應(yīng)是由于銅表面特有的光吸收特性,導(dǎo)致觀察到的熒光信號減弱或消失。改用SYTOX AADvanced是因為其發(fā)射光譜向更長波長偏移,因此可以在與銅表面接觸時觀察其信號。
金黃色葡萄球菌8325或銅綠假單胞菌PAO1從-80°C儲備培養(yǎng)物中復(fù)蘇,劃線接種于溶菌肉湯(LB)瓊脂平板(5 g L?1酵母提取物(Oxoid,Roskilde,Denmark),10 g L?1tryptone(Oxoid),10 g L?1NaCl(Merck,USA),pH 7.5)并在37±1°C下培養(yǎng)24±2小時。將改良的活/死染料混合物涂布在接種的平板上,在黑暗中培養(yǎng)5-10分鐘。使用5μL接種環(huán),將染色的細(xì)菌從平板轉(zhuǎn)移到銅銀合金涂層或未涂層的AISI 316 25x75 mm載體上,模擬細(xì)菌生物膜,并用玻璃蓋玻片覆蓋。接種的載體立即在Zeiss LSM 880倒置共聚焦激光掃描顯微鏡下使用Plan-Apochromat 63x/1.40油鏡微分干涉對比(DIC)物鏡(Zeiss,Germany)進(jìn)行檢查。使用488 nm激光進(jìn)行激發(fā),使用561 nm濾光片進(jìn)行發(fā)射,以捕獲SYTO 9(發(fā)射峰498 nm)和SYTOX AADvanced(發(fā)射峰647 nm)的信號。金屬基底處的細(xì)菌以135μm x 135μm的視野成像,Z方向增量約為0.5μm。圖像堆棧在100分鐘的時間序列內(nèi)每5分鐘捕獲一次。
2.5圖像處理和生物量定量:
圖像處理使用IMARIS軟件包(Bitplane AG,451 Switzerland)完成。通過使用COMSTAT 2(www.comstat.dk)對每種測試微生物和材料組合的三個實驗重復(fù)進(jìn)行活細(xì)胞和死細(xì)胞比率的生物量定量,使用閾值因子5,不進(jìn)行連通體積過濾。
2.6金屬表面的pH監(jiān)測
金黃色葡萄球菌8325來自-80°C儲備培養(yǎng)物,劃線接種于LB平板,并在36±1°C下培養(yǎng)24±2小時。將單個菌落加入5 mL LB肉湯中,在36±1°C下培養(yǎng)24±2小時。在4000 g下離心5分鐘收集細(xì)菌細(xì)胞,重懸于0.15 M NaCl溶液中,并使用分光光度計(UV 1800,Shimadzu,Japan)調(diào)整至OD600為2.0。將0.15 M NaCl溶液配制的0.5%瓊脂糖熔化,并將4 mL倒入帶可拆卸腔室的單腔玻片(16 x 50 x 5 mm)(Ibidi,Germany)中。使瓊脂糖在室溫下冷卻并固化至少10分鐘,然后反轉(zhuǎn)凝膠基質(zhì)以暴露更光滑的一面。將250μL金黃色葡萄球菌8325細(xì)菌懸浮液涂布在表面,風(fēng)干5分鐘。使用pH微電極(PH25,尖端直徑≈25μm,Unisense A/S)進(jìn)行pH測量,線性范圍為pH 4-9,90%響應(yīng)時間<10秒。pH微電極與浸入瓊脂糖基質(zhì)中的參比微電極(REF-100,尖端直徑≈100μm;Unisense A/S)結(jié)合使用,以確保與微電極的電接觸。
pH微電極通過在三種pH緩沖液(pH 4.01,7.00和10.01,在實驗溫度下)中的傳感器讀數(shù)進(jìn)行校準(zhǔn),并在校準(zhǔn)范圍內(nèi)對pH呈線性響應(yīng),信號與pH的比率約為56 mV每pH單位。將pH電極連接到萬用表(Unisense A/S),數(shù)據(jù)采集在運行軟件(SensorTrace Suite;Unisense A/S)的PC上進(jìn)行。操作期間,將微傳感器安裝在連接PC的電動微操縱器(MM33-2,MC-232;Unisense A/S)上,由專用定位軟件(SensorTrace Suite;Unisense A/S)控制。將接種的凝膠基質(zhì)放在銅銀合金涂層或未涂層的AISI 316基底載體(25x75 mm)上,并盡快將電極小心地放置在距金屬表面安全距離(<100μm)內(nèi)。然而,在一個重復(fù)中,傳感器定位緩慢,未記錄到初始的pH上升。因此,使用模型(y=a(ln(x))+b)對該重復(fù)進(jìn)行擬合,以extrapolate其初始pH上升。還在沒有細(xì)菌接種物的銅銀合金涂層或未涂層AISI 316表面監(jiān)測了pH。此處,pH動力學(xué)比存在細(xì)菌時更快,因此為了捕獲初始的pH上升,將傳感器定位在靠近表面(<100μm)的位置,并在表面滴加一滴0.5%低熔點瓊脂糖(Ultra Pure LMP Agarose,Invitrogen,USA),覆蓋傳感器和參比電極的尖端。液滴(100μL)在28°C下滴加,瓊脂糖在與合金涂層表面接觸后立即固化。
2.7金黃色葡萄球菌8325暴露于pH 8.0至9.5的1 M Tris-HCl緩沖液
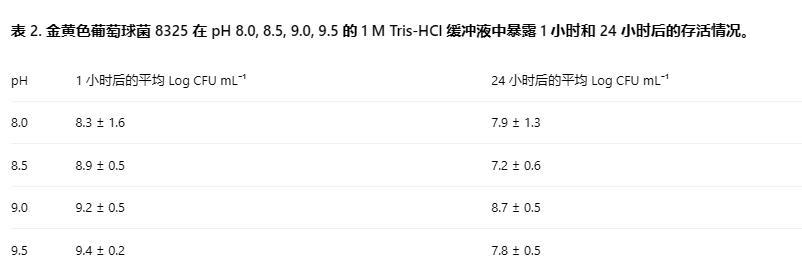
金黃色葡萄球菌8325從-80°C儲備培養(yǎng)物中復(fù)蘇,劃線接種于腦心浸液(BHI)瓊脂平板(Oxoid,CM1135)上,并在36±1°C下培養(yǎng)24±2小時。將單個菌落加入5 mL BHI肉湯中,在36±1°C下培養(yǎng)24±2小時。制備1 M Tris-HCl緩沖液(121.1 g Tris Base(Trizma,Sigma-Aldrich),700 mL dH?O),并使用濃HCl(Sigma-Aldrich)將pH調(diào)節(jié)至8.0,8.5,9.0,9.5。使用分光光度計(Novaspec III Visible Spectrophotometer,Amersham Biosciences)將細(xì)菌懸浮液調(diào)整至OD600為2.0,并將1 mL轉(zhuǎn)移至Eppendorf管(Eppendorf AG,Hamburg)中。在4000 g下離心5分鐘收集細(xì)菌細(xì)胞,并重懸于1 mL 1 M Tris-HCl緩沖液中。在暴露1小時和24小時后對細(xì)菌懸浮液進(jìn)行取樣。通過系列稀釋和在BHI-瓊脂上鋪板測定懸浮液中細(xì)菌的存活密度(CFU mL?1)。所有實驗進(jìn)行三個生物學(xué)重復(fù);報告平均值和重復(fù)間的標(biāo)準(zhǔn)差(表2)。
 相關(guān)新聞
相關(guān)新聞