熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
體內(nèi)癌癥饑餓療法
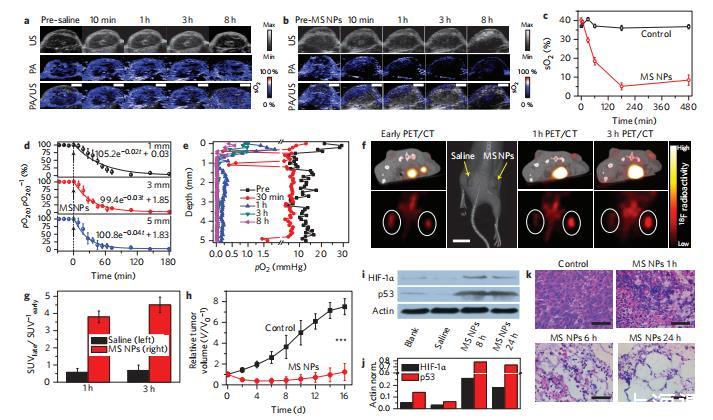
圖5 MS NP介導(dǎo)的體內(nèi)腫瘤饑餓療法。
然后,在雙側(cè)4T1異種移植腫瘤小鼠身上評(píng)估了MS NPs作為體內(nèi)DOA用于腫瘤饑餓療法的潛在資格,在右側(cè)腫瘤內(nèi)注射MS NPs,在左側(cè)腫瘤內(nèi)注射生理鹽水作為對(duì)照。通過多波長(zhǎng)光聲(PA)和B型超聲(US)圖像的聯(lián)合注冊(cè),實(shí)時(shí)定量監(jiān)測(cè)瘤內(nèi)血氧飽和度(sO2)的變化,即血紅蛋白結(jié)合氧的水平。對(duì)照組的sO2值幾乎保持不變,約為37%,與注射前持平(圖5a,c),這證實(shí)了4T1實(shí)體瘤在此期間的輕微缺氧性質(zhì),以及生理鹽水本身對(duì)瘤內(nèi)sO2的影響微乎其微。值得注意的是,從注射MS NPs十分鐘后開始,sO2就急劇下降,這種下降趨勢(shì)一直持續(xù)到三小時(shí),瘤內(nèi)血氧幾乎被完全清除(圖5b、c),這表明HbO2被有效脫氧。同時(shí),金標(biāo)準(zhǔn)氧微電極顯示,腫瘤組織中溶解的游離氧也同樣被徹底清除(圖5d、e)。瘤內(nèi)溶解氧原始微輪廓的明顯波動(dòng)表明,實(shí)體瘤中的氧分布是不均勻的,而在注射MSNP后,這種不均勻性被大幅消除,達(dá)到了持久的零氧張力。從理論上講,細(xì)胞生長(zhǎng)的有利微環(huán)境主要依賴于血紅蛋白結(jié)合氧和組織內(nèi)溶解氧之間的平衡,因此腫瘤內(nèi)這兩種氧的完全耗竭將不可避免地導(dǎo)致嚴(yán)重缺氧以及隨后的細(xì)胞壞死和凋亡。
此外,還進(jìn)行了體內(nèi)18F-MISOPET/CT成像,以評(píng)估瘤內(nèi)缺氧水平和非腫瘤區(qū)域的潛在誤缺氧。與PA/US結(jié)果一致,早期PET/CT圖像顯示治療前的缺氧水平相當(dāng),這證實(shí)了雙側(cè)腫瘤在這一階段的輕微缺氧性質(zhì)(圖5f)。盡管18F-MISO放射性在體內(nèi)不可避免地會(huì)發(fā)生核衰變和新陳代謝損失,但在注射MSNP一小時(shí)后的PET/CT圖像中,仍觀察到18F-MISO攝取大大增強(qiáng)(圖5f、g)。更令人興奮的是,在三小時(shí)后的PET/CT圖像中,發(fā)現(xiàn)缺氧區(qū)域覆蓋了整個(gè)腫瘤區(qū)域,而腫瘤周圍的正常組織中沒有發(fā)現(xiàn)任何新產(chǎn)生的缺氧區(qū)域。作為陰性對(duì)照,皮下注射MS NPs后,正常組織的血液sO2和氧張力沒有明顯變化,這進(jìn)一步證實(shí)了MS NPs在體內(nèi)的酸性敏感性和特異性,從而消除了對(duì)正常pH值的非癌組織的潛在副作用的擔(dān)憂。
令人興奮的是,與僅注射生理鹽水的對(duì)照組相比,DOA饑餓的腫瘤生長(zhǎng)速度要慢得多,這證實(shí)了瘤體內(nèi)(i.t.)給藥MS NPs是一種高效的腫瘤生長(zhǎng)抑制劑,而且在主要器官組織中檢測(cè)不到毒性(圖5h)。重要的是,瘤內(nèi)過氧化氫也同時(shí)被消耗掉了。此外,與廣泛報(bào)道的缺氧誘導(dǎo)p53積累的情況一致,通過這種外源脫氧,HIF-1α也被發(fā)現(xiàn)顯著上調(diào),從而使腫瘤中的p53凋亡通路恢復(fù)活力(圖5i、j),進(jìn)而導(dǎo)致癌細(xì)胞快速凋亡。不出所料,除了體內(nèi)顯示的直接缺氧誘導(dǎo)的線粒體損傷外,病理血沉和伊紅(H&E)染色檢測(cè)也顯示,DOA饑餓的腫瘤在一小時(shí)后出現(xiàn)明顯的纖維化、壞死和凋亡,這種損傷在24小時(shí)后變得更加嚴(yán)重(圖5k)。
MS NPs在體內(nèi)脫氧過程中的演變
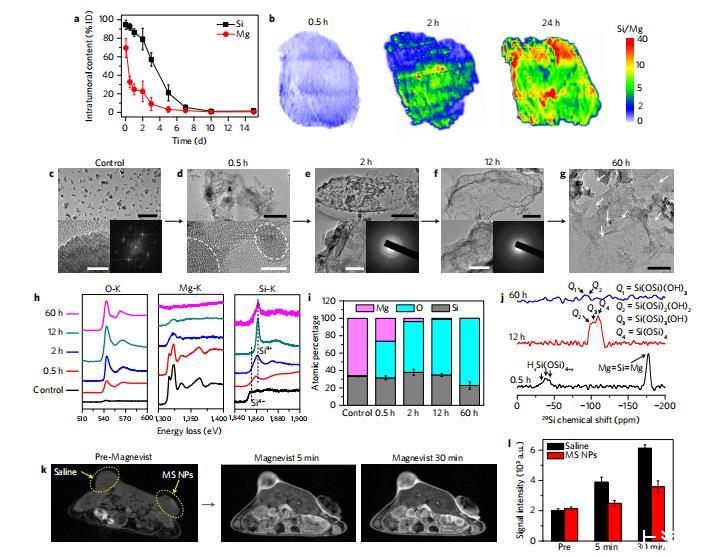
圖6 MS NPs在體內(nèi)癌癥饑餓治療過程中的演變。
為深入理解這種DOA誘導(dǎo)的癌癥饑餓療法,我們進(jìn)一步研究了腫瘤內(nèi)MS納米顆粒的時(shí)間動(dòng)態(tài)演變。與體外實(shí)驗(yàn)結(jié)果一致,硅元素在腫瘤中被滯留并逐漸降解,而鎂元素則快速排出(圖6a)。通過激光解吸電離質(zhì)譜(LD-IMS)掃描的硅鎂比分布圖顯示了腫瘤內(nèi)硅鎂的相對(duì)分布(圖6b)。在部分注射MS納米顆粒0.5小時(shí)后,觀察到硅鎂比約為0.8的均勻分布,證實(shí)了其在高腫瘤間質(zhì)液壓力下仍能快速滲透44。隨后,富含硅的微團(tuán)塊呈現(xiàn)色差特征并逐漸增大,同時(shí)硅鎂比整體升高(補(bǔ)充圖25)。由于腫瘤酸性存在高度異質(zhì)性45,硅鎂比較高的區(qū)域被視為酸性更強(qiáng)的區(qū)域。值得慶幸的是,這種非均勻酸性分布并未導(dǎo)致氧耗盡的異質(zhì)性,這一點(diǎn)從全腫瘤范圍的顯著耗氧和缺氧生成現(xiàn)象中得到印證(圖5b,d–f)。
從更微觀的角度來看,時(shí)間序列TEM圖像和電子能損耗譜(EELS)顯示,瘤內(nèi)Mg2Si晶體納米顆粒逐步轉(zhuǎn)變?yōu)闊o定形微片。這種轉(zhuǎn)變伴隨著顯著的氧捕獲和鎂消除,更明顯的是,硅的價(jià)態(tài)從-4急劇逆轉(zhuǎn)為+4(圖6c-i)。根據(jù)29Si固態(tài)魔角旋轉(zhuǎn)核磁共振(MASNMR)結(jié)果(圖6j),發(fā)現(xiàn)最初的脫氧產(chǎn)物是不飽和HxSi(OSi)4-x物種,即包裹結(jié)晶MSNP的無定形物質(zhì)(圖6d)。正如定義明確的Q2和Q3物種所示,這些中間產(chǎn)物被進(jìn)一步氧化并凝結(jié)成富含硅醇基團(tuán)的SiO2微片。這一發(fā)現(xiàn)顯然證實(shí)了組織內(nèi)SiO2微片形成的溫和、逐步脫水-縮合機(jī)制,從而使這些動(dòng)態(tài)生成的聚集體成為有效的腫瘤毛細(xì)血管阻斷劑,阻止紅細(xì)胞的循環(huán)。
此外,還使用Magnevist作為T1對(duì)比劑,對(duì)雙側(cè)4T1腫瘤小鼠進(jìn)行快速掃描磁共振成像(MRI),以估計(jì)瘤內(nèi)血管的通透性。注射了生理鹽水的左側(cè)腫瘤在五分鐘內(nèi)迅速變亮,相比之下,注射了MSNP的右側(cè)腫瘤的信號(hào)增強(qiáng)要慢得多(圖6k、l),這證實(shí)了原位形成的二氧化硅微片大大降低了腫瘤血管的通透性。血管通透性在很大程度上受到抑制,阻礙了血氧的進(jìn)一步供應(yīng),從而導(dǎo)致瘤內(nèi)長(zhǎng)期缺氧。此外,注射外源二氧化硅微片后,發(fā)現(xiàn)沒有血栓形成現(xiàn)象,也沒有觀察到明顯的腫瘤生長(zhǎng)抑制,因?yàn)樗鼈兏豢赡軡B透到毛細(xì)血管中。
更有趣的是,這些緩慢凝結(jié)的二氧化硅微片被發(fā)現(xiàn)逐漸降解成小分子硅酸,在晚期具有可識(shí)別的Q1和Q2種類(圖6j),這也是它們?cè)谀[瘤中大約七天內(nèi)完全消失的原因(圖6a。幸運(yùn)的是,在此之后,腫瘤仍然保持著嚴(yán)重的缺氧狀態(tài),這可能是由于缺氧引起的腫瘤血管損傷,主要是瘤內(nèi)血管內(nèi)皮細(xì)胞的凋亡/壞死。
總之,我們展示了一項(xiàng)概念驗(yàn)證研究,即PVP改性Mg2Si納米粒子可用作饑餓腫瘤的DOA。這些納米粒子能在酸性腫瘤微環(huán)境中有效消耗瘤內(nèi)氧。此外,無定形的二氧化硅微沉積物副產(chǎn)品可以阻塞腫瘤毛細(xì)血管,在降解前阻止再吸氧。在臨床轉(zhuǎn)化方面,對(duì)靜脈注射進(jìn)行了評(píng)估。盡管納米粒子具有生物相容性,但這種注射途徑只能輕微改善腫瘤缺氧,因此抑制腫瘤的效果較差。我們的研究結(jié)果表明,除了傳統(tǒng)的抗血管生成療法外,使用納米氧化亞氮進(jìn)行腫瘤內(nèi)脫氧也是一種很有前景的癌癥饑餓療法。還需要進(jìn)一步研究納米粒子的表面修飾,以實(shí)現(xiàn)更長(zhǎng)的血管循環(huán),從而實(shí)現(xiàn)有針對(duì)性的腫瘤積聚。
 相關(guān)新聞
相關(guān)新聞