熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
結果
MS NPs的合成與表征
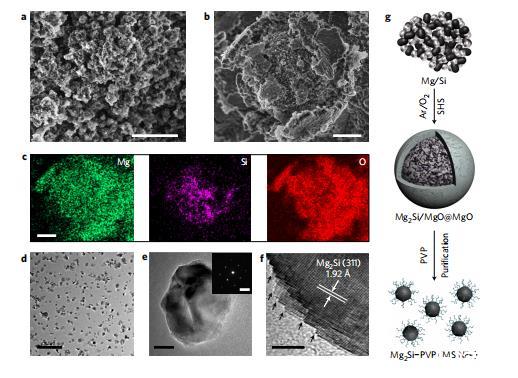
圖2 MS NPs的合成及其形態(tài)和微觀結構表征。
傳統(tǒng)上在惰性氣體中通過固體反應制備的微尺度Mg2Si粒子體積太大,無法在液體介質(zhì)中分散。為了獲得具有組織穿透性的可注射MS NPs,我們開發(fā)了一種在O2/Ar混合氣體環(huán)境下的特殊自推進高溫合成(SHS)方法。在這種方法中,O2可以與過量的鎂發(fā)生放熱反應,從而誘導鎂和硅發(fā)生后續(xù)的結合反應。圖2a中的掃描電子顯微鏡(SEM)圖像顯示,洗滌前的產(chǎn)品似乎含有大量微顆粒;X射線衍射圖樣分析顯示,這是Mg2Si和MgO的混合物。通過放大的SEM圖像和相應的裂紋顆粒的能量色散光譜(EDS)元素圖譜(圖2b、c),可以確認這些微顆粒具有確定的核殼形態(tài),即Mg2Si/MgO內(nèi)核位于薄薄的MgO外殼中。從眾所周知的晶界鎖定效應來看,作為環(huán)繞Mg2Si顆粒的高熔點相,MgO副產(chǎn)物可抑制其不必要的晶粒生長,而MgO外殼則可防止內(nèi)部Mg2Si氧化。對Mg2Si納米粒子進行洗滌以去除氧化鎂,然后用PVP對其進行修飾和透射電子顯微鏡(TEM)圖像(圖2d)表明,得到的MS NPs雖然形態(tài)不規(guī)則,但直徑小于100nm,且分散良好。此外,制備的MS NPs結晶良好,具有明顯的鋸齒狀邊緣(圖2e,f),這表明SHS過程非常迅速,沒有進一步的再結晶和增強生長。這種利用MgO副產(chǎn)物作為Mg2Si晶體生長抑制劑的特殊SHS策略(圖2g)使非聚集MS NPs的合成成為一種可注射的DOA。
對pH值敏感的脫氧效應
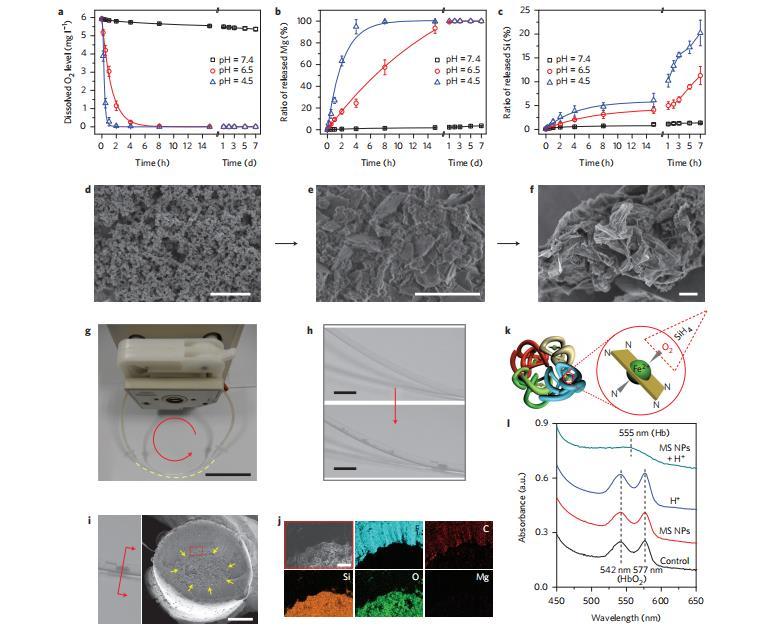
圖3合成的MS NPs對pH值敏感的脫氧效應。
Mg2Si中的Lewis堿性Si4-離子對酸性具有敏感的反應性,這使得硅烷得以釋放并開始脫氧。為了揭示MS NPs依賴于pH值的氧清除行為,我們將其密封在透析袋中,然后將透析袋放入密閉的試管中,浸入不同pH值(7.4、6.5和4.5)的緩沖介質(zhì)中。令人興奮的是,在酸性介質(zhì)中,MS NPs可使溶解氧水平急劇下降,而在pH=7.4時,其影響可忽略不計(圖3a)。此外,酸度的增加還能顯著促進氧氣的消除。脫氧溶液可以維持在缺氧狀態(tài),而不會出現(xiàn)任何可檢測到的再吸氧現(xiàn)象,這表明氧氣的消耗是不可逆的。與pH=7.4條件下未反應的MS NPs相反,在脫氧過程中發(fā)現(xiàn)透析袋內(nèi)產(chǎn)生了大量的宏觀絮凝物。這些絮凝聚集體是無定形的二氧化硅,呈現(xiàn)出數(shù)十微米大小的片狀聚集形態(tài)。除了必要的酸度外,這種動力學主導的脫氧效率還在很大程度上取決于MS NPs在培養(yǎng)基中的分散性。
鎂和硅釋放行為的定量比較進一步證實了硅的相對不穩(wěn)定性,在所有情況下,15小時內(nèi)的釋放量都小于5%,可以忽略不計,這與鎂在酸性介質(zhì)中的快速釋放形成了鮮明對比(圖3b,c)。與在pH=7.4條件下的惰性不同,MS NPs在酸性介質(zhì)中逐步演化和生長為清晰的納米片形態(tài),并最終轉化為較大的SiO2微片(圖3d-f)。至于硅烷燃燒的機理,釋放出的SiH4與溶解的O2反應首先會產(chǎn)生一系列瞬時中間產(chǎn)物,一般通式為HxSi(OH)4-x,其后的縮合物在很大程度上決定了SiO2片的尺寸(圖1)。與氣態(tài)O2相比,這種縮合相對緩慢,因為水溶液中的SiH4會逐漸釋放,這就為最終產(chǎn)物SiO2微片的形成提供了足夠的時間。這種在原位形成的二氧化硅聚集體可進一步演變成許多緊密的栓子,從而有效地阻塞模擬血液循環(huán)系統(tǒng)中的特氟龍毛細血管(圖3g-j),這表明在體內(nèi)這些形成的血栓很可能會阻塞直徑達幾十微米的腫瘤毛細血管。
除了直接溶解在血流或組織中的游離氧外,大多數(shù)氧分子都與血紅蛋白中卟啉環(huán)內(nèi)的鐵離子結合在一起(圖3k)。如圖3l所示,在含有MS NPs的酸性介質(zhì)中,氧合血紅蛋白(HbO2)可還原成脫氧血紅蛋白。結合上述自由氧的消除,MS NPs對結合氧的這種酸性特異性脫氧作用表明,在腫瘤中完全清除氧是理想的。此外,研究還發(fā)現(xiàn)硅烷中間體是一種溫和、安全的還原劑,在水溶液中經(jīng)歷了不可逆的八電子還原過程,從而能夠額外清除羥基自由基和過氧化氫,它們是癌癥中常見但潛在的有害物種。
用于癌細胞饑餓的體外脫氧技術
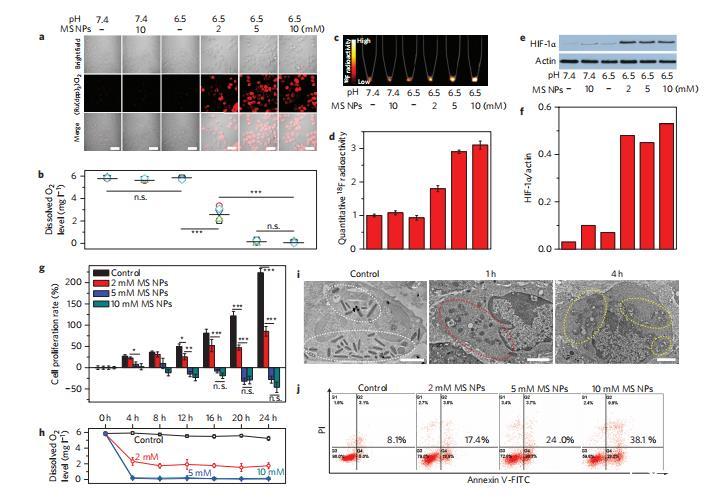
圖4體外評估MS NP介導的細胞饑餓脫氧。
在正常培養(yǎng)條件下,MS NPs及其脫氧產(chǎn)物的細胞毒性可忽略不計。為了評估它們在體外對pH值敏感的脫氧作用,我們采用了pH=6.5的酸性培養(yǎng)基來模擬腫瘤細胞外的中度酸性環(huán)境,并選擇了MCF-7人乳腺腺癌細胞,因為該細胞位于表層,可以進行實際的腫瘤饑餓給藥。令人興奮的是,加入MS NPs后,在培養(yǎng)基中觀察到了快速的酸性特異性脫氧效應,這表明在酸性環(huán)境中可以有效清除細胞內(nèi)的氧氣,細胞內(nèi)氧氣水平指示劑[Ru(dpp)3]Cl2(dpp,4,7-二苯基-1,10-菲羅啉)的紅色熒光顯著增強就是證明(圖4a,b)。此外,通過與18F標記的氟咪唑(18F-MISO)(一種能夠選擇性地與缺氧細胞結合的商用缺氧分子探針)孵育,隨后的18F正電子發(fā)射斷層掃描(PET)/計算機斷層掃描(CT)成像可對細胞缺氧水平進行定量評估(圖4c,d)。與未添加酸或MSNP的情況相比,添加酸和MSNP的情況下PET圖像中的18F-MISO放射性信號更強。這一點以及缺氧誘導因子1α(HIF-1α)蛋白表達水平的增加(圖4e,f)顯然證實了MSNP和酸性物質(zhì)的同時存在對造成細胞內(nèi)嚴重缺氧的不可或缺性。
在本研究中,MS NPs或酸度單獨誘導的細胞生長沒有可檢測到的影響。然而,它們協(xié)同誘導的細胞內(nèi)缺氧卻能有效抑制細胞增殖。在施用較高濃度MS NPs的情況下,這種缺氧會導致細胞生長受到嚴重抑制,與對照組的指數(shù)生長曲線形成鮮明對比(圖4g)。在使用低濃度(2mM)MS NPs的情況下,培養(yǎng)基缺氧(圖4h)引起的細胞缺氧程度相對較低(圖4d),但在24小時內(nèi)細胞增殖抑制率仍高達50%左右。增加5毫摩爾的劑量可有效改善抑制效果,但進一步增加10毫摩爾的劑量后,耗氧率、細胞內(nèi)缺氧水平和細胞生長抑制效率都沒有明顯提高(圖4b、d、g),這表明在5毫摩爾左右就達到了缺氧飽和。在脫氧環(huán)境中保存時,這些缺氧細胞的形態(tài)發(fā)生了巨大變化,其特征是連續(xù)的細胞剝離、膜損傷和膜溶解)。此外,與常氧細胞不同的是,脫氧細胞中的線粒體受到了不可逆的破壞,表現(xiàn)為嚴重腫脹、膜破裂和漿溢出(圖4i)。據(jù)信,這些窒息的線粒體失去了呼吸和代謝ATP生成功能,最終導致細胞壞死和/或凋亡。
為了進一步證實缺氧對細胞殺傷的唯一作用,并排除已形成的二氧化硅微片的任何潛在影響,我們設計了一種特殊的實驗裝置。細胞在pH值為7.4的培養(yǎng)基中培養(yǎng),并置于有蓋容器中,但在有蓋容器內(nèi)放置了一個開放的微離心管,其中裝有pH值為6.5的MSNP溶液。管內(nèi)會發(fā)生快速脫氧,從而導致外部培養(yǎng)基中的缺氧水平逐漸升高。盡管細胞內(nèi)氧消耗緩慢,但細胞活性也同樣下降,同時細胞凋亡和線粒體損傷顯著增加(圖4j),這排除了缺氧以外的細胞毒性可能原因。更重要的是,MSNP介導的脫氧作用一般適用于其他細胞系的增殖抑制和細胞內(nèi)羥自由基或過氧化氫的消除。所有這些結果都表明,MS NPs是抑制細胞增殖的一種有利的酸性特異性DOA。
 相關新聞
相關新聞