熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
隨機選擇18個柱,使用改性土壤進行絮凝處理。將改性土壤懸浮液加入水華水中,并用玻璃棒攪拌。每個柱中改性土壤的最終濃度為3 mg/L殼聚糖和100 mg/L土壤。將絮凝后的柱靜置3小時,使藻絮體沉降。隨后,從絮凝后的柱中取出9個,覆蓋一層1厘米厚的天然土壤。僅進行絮凝處理的9個柱標記為"F-no capping",進行絮凝-覆蓋處理的9個柱標記為"F-capping"。其余9個未進行任何處理的柱設為"對照"。
所有柱在底部上方約15厘米處用布包裹以確保黑暗環境。此后,將每個處理組(對照、F-no capping、F-capping)的9個柱平均分為三部分(每組三個柱),分別在8°C、25°C和35°C下于熒光燈(2000-3000勒克斯,12小時光照/12小時黑暗)下培養。為使不同處理中的藻活力處于相同水平并使藻培養物適應新溫度,所有柱在采樣前在相應溫度條件下穩定10小時。
活力實驗持續60天,在第0、15、30、45和60天測量葉綠素a濃度。第0天的樣品取自對照組表層水以下10厘米處,并用0.45μm膜過濾。F-no capping和F-capping組的樣品為柱底沉積的藻絮體。對于葉綠素a濃度分析,所有樣品用90%丙酮在4°C下提取24小時,并用分光光度計測量。使用第0天和第60天的相同樣品分析形態、光合作用和呼吸作用。樣品在6000 rpm下離心3分鐘,用2.5%戊二醛預固定4小時,并用磷酸鹽緩沖液洗滌。然后,樣品用1%四氧化鋨后固定2小時,再次用磷酸鹽緩沖液洗滌。洗滌后的樣品依次通過30%、50%、70%、85%、95%和100%乙醇溶液脫水兩次,并用真空干燥器干燥。完全干燥的樣品隨后安裝在銅樁上,鍍金,并用掃描電子顯微鏡(SEM,S-3000N,Hitachi,Japan)觀察。對于光合作用和呼吸作用分析,將樣品加入微呼吸瓶(4 mL)中,并在與藻類批次培養相同的條件下培養。將采樣瓶移入培養箱后,使用微呼吸系統(MRS,Unisense,Danmark)連續測量光合作用和呼吸速率。在每個培養周期(即10小時光照/10小時黑暗)內,使用O2微傳感器每2分鐘連續測量每個樣品中的O2濃度60秒。
氮同化實驗。與藻類共培養后,使用30μm網收集15N標記的銅綠微囊藻細胞,并用去離子水沖洗至少10次以去除未同化的15N-NO3。標記的銅綠微囊藻的δ15N值為1072±13‰(n=2),將一定劑量的藻類加入過濾的湖水(30μm)中,用于形成水華水(7.3-7.7 x 10^7細胞/mL)。總共40個柱(直徑8.4厘米,高50厘米)填充10厘米沉積物和1.6升水華水,并在實驗前穩定3天。沉積物采集自中國太湖。柱底上方15厘米區域用布包裹以避免環境光對沉積物的影響。所有柱均使用改性土壤進行絮凝處理,然后覆蓋一層1厘米厚的天然土壤。覆蓋處理后,在20個柱中種植蓖齒眼子菜幼苗,命名為"有植被"組。另外20個柱保持無植被狀態,命名為"無植被"組。此后,從有植被組和無植被組中各取10個柱,在8°C的光照培養箱中培養。每組剩余的10個柱在25°C下培養。兩種培養條件均設定在熒光燈(2000-3000勒克斯,12小時光照/12小時黑暗)下。選擇8°C和25°C的溫度來模擬太湖蓖齒眼子菜在春季和初夏的萌發和快速生長階段。
在絮凝-覆蓋處理后立即(第0天)以及第10、17、27和45天采集植物(幼苗)和沉積物樣品(頂部5厘米)。每次采樣時,從兩個隨機選擇的柱(作為重復)中采集,并從其中收獲整個植物生物量。
分別將沉積物和植物均質化、干燥,并使用與Flash EA1112元素分析儀聯用的Delta Plus Advantage質譜儀(Finnigan MAT)分析穩定氮同位素比率(15N/14N)。15N豐度使用相對于大氣氮標準的常規delta符號表示:
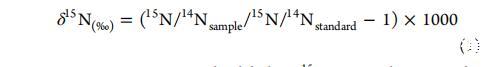
此外,為了比較不同處理組沉積物和植物中標記15N的積累量,應計算過量15N以確定標記15N的絕對摻入量。數據以干樣中15N的過量濃度表示,并根據以下公式計算:
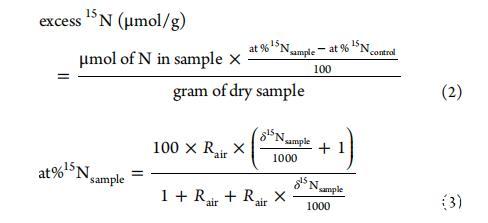
重復測量之間的分析誤差通常在±0.1‰以內。其中at%15Ncontrol代表第0天的值,δ15N表示為相對于大氣氮比率Rair=0.0036765的過量值。
統計分析。使用Origin 8.0(OriginLab,Northampton,MA,USA)和SPSS 16.0(IBM Corporation,Armonk,NY,USA)分別進行繪圖和數據分析。所有比較的顯著性水平設定為P<0.05。在藻生物量活力實驗中,使用雙因素方差分析及事后Duncan多重范圍檢驗分別比較不同處理組在不同溫度下的葉綠素a濃度、光合作用和呼吸速率。在檢驗中,組別(對照、絮凝、絮凝+覆蓋)和溫度(8°C、25°C、35°C)是兩個獨立因素,葉綠素a濃度、光合作用和呼吸速率是每個分析中的因變量。使用單因素方差分析及事后Turkey檢驗檢驗每個溫度下同一處理組內的葉綠素a濃度。在氮同化實驗中,使用雙因素方差分析及事后Duncan多重范圍檢驗分析蓖齒眼子菜對15N同化速率能力的差異。處理(有植被和無植被)和溫度(8°C和25°C)是獨立因素,15N同化速率是因變量。此外,進行線性相關分析以檢驗整個實驗過程中15N同化速率與蓖齒眼子菜生物量之間的關系。
結果
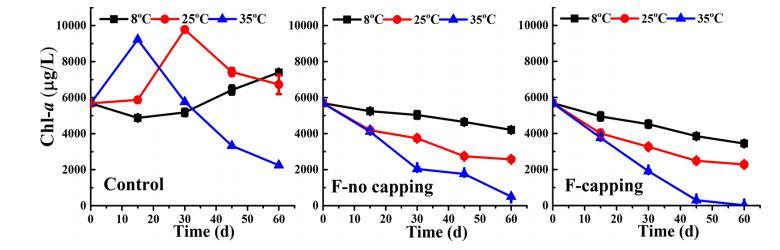
藻生物量活力。 所有柱中的初始葉綠素a濃度為5670 μg/L。在對照組中,葉綠素a濃度顯著高于初始值,并在第60天分別達到7397 μg/L(8°C)和6731 μg/L(25°C)。35°C下的葉綠素a濃度在第15天顯著增加至9224 μg/L,隨后逐漸下降至第60天約2243 μg/L。在F-no capping和F-capping組中,在所有培養溫度下,葉綠素a濃度隨采樣時間持續下降。在第60天,F-no capping和F-capping組之間的相應樣品觀察到顯著差異(P<0.05)。在8°C、25°C和35°C下,F-capping組中葉綠素a濃度分別下降至約3444、2277和18 μg/L,而F-no capping組中的值分別為4203、2574和500 μg/L。此外,較高的溫度加速了F-no capping和F-capping組中葉綠素a濃度的下降(P<0.05)。溫度和處理的交互作用對葉綠素a濃度變化沒有顯示出顯著影響(P>0.05)。
第0天收集的藻細胞顯示出完整的形態,對照組、F-no capping和F-capping組之間沒有明顯差異。實驗結束時,從三個系統中收集的大多數藻細胞在8°C下總體上顯示出完整的形態。然而,與對照組相比,在25°C下培養的F-capping組收集的藻細胞明顯變形和裂解。此外,在35°C下培養的F-capping組中觀察到比對照組和F-no capping組更多的裂解細胞。

實驗開始時,從所有三組收集的銅綠微囊藻細胞都能維持正常的光合作用和呼吸速率,這表明光照階段產生的氧氣足以維持藻類在黑暗階段的呼吸作用。培養60天后,從對照組和F-no capping組收集的藻細胞在8°C和25°C下仍能維持光合作用,這反映在光照階段氧氣變化率為正值。然而,在25°C下,F-no capping組的光合作用效率比對照組低八倍。盡管從F-capping組收集的細胞在8°C的光照階段能維持光合作用,但其效率遠低于對照組。值得注意的是,在25°C下培養的F-capping組細胞即使在光照培養階段也顯示出負的O2變化率,表明藻生物量發生了死亡和衰亡。在35°C下培養60天后,所有三個系統都發現了藻細胞死亡和衰亡,這反映在負的O2變化率上。然而,絮凝-覆蓋處理加速了藻細胞死亡和衰亡,這可以通過F-capping組的O2消耗速率顯著高于F-no capping組或對照組(P<0.05)來反映。應當指出,溫度和處理之間的交互作用顯著影響光合作用和呼吸速率(P<0.05)。
 相關新聞
相關新聞