熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
2.4心肌缺血再灌注模型
所有動物實驗均遵守有關實驗動物護理和使用的相關法律和機構指南。該方案獲得了中國科學院深圳先進技術研究院倫理委員會的批準。簡要地說,使用10%氯胺酮(0.3 mL/kg體重)腹腔注射麻醉八周大的雌性Sprague?Dawley大鼠;根據需要額外給予劑量以維持麻醉。然后使用5-0絲線結扎左前降支冠狀動脈誘導局部心肌缺血。通過心電圖S-T段抬高確認缺血,缺血30分鐘后,通過尾靜脈注射MBs或H2-MBs。再灌注3或24小時后,重新結扎冠狀動脈。一些大鼠被隨機選擇注射伊文思藍染料以分析患有心肌梗死后的潛在受損區域。
2.5梗死大小的評估
為了評估梗死大小,收集心臟,切成5節,然后在37℃下用0.1%三苯基四唑氯化物(TTC)溶液培養20分鐘。切片照相和稱重。非梗死的活體心肌染成紅色,而梗死組織保持未染色(白色),然后使用計算測圖法(ImagePro Plus版本6.1)進行測量。梗死大小計算公式為[(A1×W1)+(A2×W2)+(A3×W3)+(A4×W4)+(A5×W5)],其中A是切片的梗死區域,W是各個部分的重量。梗死大小以對照心臟和H2-MB處理心臟的總心臟重量的百分比表示,如先前描述的那樣。
2.6超聲心動圖檢查
治療后兩天,經過30分鐘的缺血和24小時的再灌注處理后,大鼠吸入1.5%異氟醚麻醉。動物被固定在可定位平臺上,仰臥位,使用Vevo 2100系統和MS-250探頭進行短軸超聲心動圖檢查(掃描速度1000 Hz,頻率21 MHz)。LV尺寸和FS%和EF%是在副胸長軸視圖中使用M模式獲得的,從尾緣到前緣。根據美國超聲心動圖學會指南計算超聲心動圖變量。
2.7血紅素和伊紅(H&E)染色和免疫組化
大鼠在30分鐘的缺血和24小時的再灌注后,用七氟烷麻醉,然后解剖心臟,用4%緩沖福爾馬林在4℃固定24小時。然后,將心臟石蠟包埋并切成5μm厚的切片,將切片脫脂,并使用PBS重新水化,然后用H&E(H&E染色試劑盒,Sigma-Aldrich)染色。隨后,將切片在4℃過夜孵育,使用兔抗大鼠caspase-3單克隆抗體(1:400稀釋;Cell Signaling),然后在PBS中三次洗滌后,將切片在室溫下與山羊抗兔IgG二抗(1:1000稀釋;Abcam)孵育30分鐘。免疫反應信號使用3,3'-二氨基聯苯胺可視化。然后,用蘇木精藍染色,并在顯微鏡下檢查(Q500MC;Leica圖像分析系統)。
2.8 TUNEL檢測
根據產品說明書使用原位細胞死亡檢測試劑盒進行TUNEL檢測。簡而言之,使用末端脫氧核苷酸轉移酶催化將數字素標記的dUTP嵌入DNA中,然后在盲目方式下計數染色的切片中TUNEL陽性細胞核的數量。
2.9 ELISA檢測
將心臟組織按照補充方法描述進行均質處理。然后,在上述方法制備的上清液中使用商業化試劑盒(eBioscience,明尼阿波利斯,MN)根據制造商的說明書測量TNF-α、IL-1β和8-OHdG水平。樣品的吸光度在450 nm波長處用微板讀數器(多功能酶標Synergy,BioTek)讀取,然后根據TNF-α、IL-1β和8-OHdG標準曲線的光密度值計算濃度。使用卡巴亞酶-3比色法檢測卡巴亞酶-3活性,從中確定吸光度為405 nm,然后計算濃度。
2.10丙二醛(MDA)和MPO的測量
使用MDA和MPO試劑盒(南京建成生物研究所,中國)確定心肌組織中的MDA和MPO水平。簡要地說,使用上述方法制備組織勻漿,使用BCA蛋白定量法以BSA為標準確定MDA(nmol/mg)和MPO水平(U/mg),并將其歸一化為總蛋白。
2.11心肌組織中ROS的定量
在30分鐘的缺血和40分鐘的再灌注后,動物被安樂死,取出心臟,然后均勻地勻漿心臟樣本。然后,將勻漿物立即與10μM 5-(和-6)-氯甲基-2',7'-二氯二氫熒光素乙酯乙酸酯(CM-H2DCFDA,由分子探針購買)、5μM二氨基熒光素-2-乙酸酯(DAF-2DA,由大一純化學品公司購買)或5μM硝基噻唑啉鹽(NBT)反應30分鐘,以檢測細胞H2O2、NO?或O2??水平。然后,使用自動微板讀數器(BioTek Synergy4)在510 nm處讀取CM-H2DCFDA和DAF-2DA的熒光信號,激發波長為490 nm。由于O2??將NBT還原為NBT二甲腙的吸光度在550 nm處檢測。我們使用0.4μM 3'-(p-羥基苯基)熒光素(HPF,由分子探針購買)來檢測?OH,然后測量515 nm處的熒光信號,激發波長為490 nm。
2.12統計分析
數據表示為平均值±SEM,并使用SPSS 13.0(芝加哥,IL)進行分析。進行單一比較的未配對雙尾學生t檢驗和多組比較的方差分析(ANOVA)。P值<0.05被認為是統計學上顯著的。
3結果
3.1 H2-MBs的表征
首先開發了一種通過以下步驟將H2裝載到MBs中的程序:薄膜形成/水合、瓶封、八氟丙烷(C3F8)置換、H2置換和振動(圖1a)。比較了不同C3F8/H2比率(體積/體積)的MBs的特征差異,發現隨著H2添加量的增加,MBs的濃度減小。在沒有C3F8的情況下產生了少量的MBs(C3F8/H2=0:3)(圖S1),其MB產量約為其他組的約100倍(表S1)。通常,H2-MBs在顯微鏡下顯示出多分散和球形形態(圖S2)。在C3F8/H2比率為3:0和1:1時,MB的平均直徑、大小分布和MB穩定性沒有顯著差異,而在缺乏C3F8時MB大小增加(圖S3和S4和表S1)。當使用C3F8/H2比率為1:1時,H2-MBs中的H2含量為1.46±0.08和0.14±0.13μmol H2/mL MB懸浮液(表S1)。因此,所有后續的體外和體內研究均使用了最佳配方(C3F8/H2比率為1:1)。
接下來,通過監測H2水平的時間變化來分析H2釋放曲線,使用直接插入H2-MB懸液的針狀氫氣電極在PBS或大鼠LV腔中。結果顯示,在加入H2-MBs后,PBS中的H2水平開始增加,并在2分鐘后達到最大水平(180±0.02μmol/L)(圖1b)。動物體內的H2釋放速率與PBS中觀察到的相似,最大值為119±0.02μmol/L,注射H2-MBs后2分鐘。相反,在體內,H2濃度的衰減速率更快,在10分鐘后,H2水平為9.02±0.02μmol/L(圖1c)。在加入對照MBs(僅含純C3F8的載體)后,體內和體外的H2水平均不發生變化。
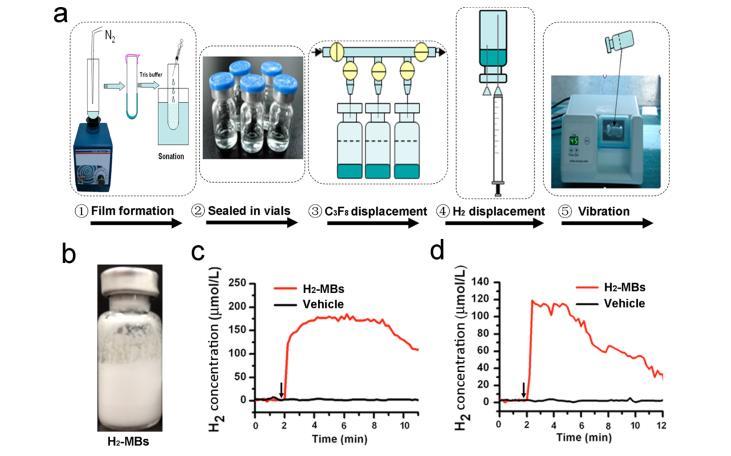
圖1.H2-MBs的制備和表征。(a)H2-MBs制備的示意圖。將由DSPC和DSPE-PEG2000(摩爾比=90:10)組成的15毫克磷脂混合物溶解在氯仿中。在形成膜和水合后,將含水分散液(脂質體)裝入4 mL瓶中(每瓶1 mL),并用八氟丙烷(C3F8)置換瓶中的空氣。隨后,顛倒瓶子,并用注射器注入一定量的H2。因此,瓶子中擠出相等體積的C3F8。震動45秒后獲得H2-MBs。(b)從上述方法中獲得的H2-MBs的代表性圖像(C3F8/H2比為1:1)。(c、d)體內外H2釋放的代表性時間曲線。
在體外實驗中,將4×109 H2-MBs或對照MBs(載體)加入5 mL PBS中,并使用針式氫氣電極檢測來自MBs的H2釋放。在體內實驗中,將2×1010 H2-MBs或對照MBs靜脈注射到大鼠體內,并使用針式氫氣電極連續記錄血液中的H2濃度,該氫氣電極插入LV腔中(n=5)。箭頭表示添加H2-MBs或對照MBs的時間。