熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
3.4.變體MsdoY165F
氨基酸序列中位置165的酪氨酸被替換為苯丙氨酸。thereby,酪氨酸的羥基從預測的蛋白質活性位點中移除,但結合口袋的構架不應受影響。對于MsdoY165F,測定得到與野生型相同的Km值0.06 mM。催化效率降至20.37 mM?1s?1;而比活性測定為10.22μmol min?1mg?1,相當于野生型活性的約70%。
為便于比較獲得的動力學數據,結果總結于表2。野生型酶及其活性變體的比活性在MsdoQ64A和MsdoY165F情況下非常相似。MsdoR66A顯示僅非常低的活性,且由于每次測量需要大量蛋白質,未確定動力學數據。對于變體MsdoH93L、MsdoH95L、MsdoH163L和MsdoC100S,無法記錄動力學數據,因為酶未顯示任何活性。
4.討論
在本研究中,生成并表征了最近鑒定和表征的V.paradoxus B4巰基琥珀酸雙加氧酶的酶變體,以闡明對酶活性和底物配位重要的氨基酸殘基。為此,通過定點誘變替換了Msdo的七個不同氨基酸殘基。

Cdo及其同源物氨基酸序列中存在三個高度保守的組氨酸殘基(圖1),這些殘基對輔因子配位和底物定位重要。Msdo中位置93、95和163的三個組氨酸殘基各被亮氨酸殘基替換。由于對應H93和H95的兩個組氨酸殘基被認為對半胱氨酸雙加氧酶及其同源酶中的輔因子配位至關重要,生成的變體觀察到的酶活性完全喪失證實了這些氨基酸在MsdoB4中的預期重要性。鐵輔因子的重要性先前已詳細研究。其中描述Msdo在沒有Fe(II)作為輔因子時未顯示任何活性,且其他金屬離子(例如銅)無法恢復酶活性。此外,H163顯然也對酶活性至關重要,thus表明其在底物在Msdo活性位點中定位的重要作用,如同人類Cdo活性位點中的H155。
Driggers及其同事表征了細菌Cdo及其同源物的兩種不同結構類型,他們區分了“Arg型”和“Gln型”。“Arg型”在活性位點具有保守的精氨酸殘基,是表現Cdo活性的酶的特征。另一方面,“Gln型”在活性位點攜帶保守的谷氨酰胺殘基替代精氨酸,這是表現不同底物特異性的Cdo同源物(如Mdo)的特征。在MsdoB4中,兩種殘基都存在(Q64和R66),而Q64對應保守的Y58,R66對應保守的R60殘基。為確定位置64的谷氨酰胺殘基對酶活性的作用,將其替換為丙氨酸殘基,產生酶變體MsdoQ64A。該變體表現出與野生型Msdo相似的比活性(見表2),但有趣的是顯示顯著增加的Km值,表明對底物的親和力較低。因此,可能由于活性結合位點的變化,底物結合效率較低,導致在較高底物水平下達到最大反應速率,與野生型酶相比。盡管Q64A替換肯定對酶活性有影響,但該氨基酸殘基似乎對催化非必需。
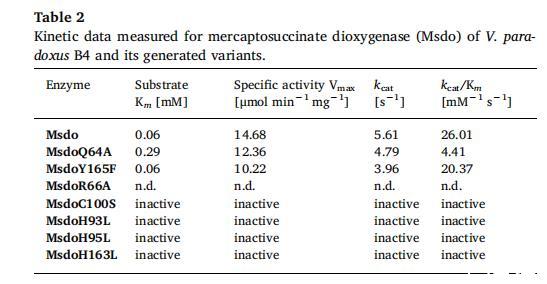
對于人類Cdo,當保守精氨酸(R60)被替換時,觀察到活性降低至約30%并損失50%的配位亞鐵。R66替換對Msdo活性的影響更強。僅當應用至少38μg酶時才能觀察到活性。這一發現支持了該氨基酸可能參與底物配位的假設,可能作為氫網絡的一部分,如同人類Cdo中觀察到的那樣。考慮到Q64A替換的較小影響,人們可能假設Msdo是“Arg型”Cdo同源物,盡管它對半胱氨酸無活性。
另一個推測參與底物配位的氨基酸殘基是Msdo位置165的酪氨酸(對應真核Cdo的Y157)。此外,Y157是催化三聯體的一部分,并與半胱氨酸(C93)交聯,導致真核Cdo活性增強。然而,這種交聯對活性非必需,且不存在于細菌Cdo同源物中。為研究該酪氨酸在Msdo酶活性中的作用,將其替換為苯丙氨酸,產生變體MsdoY165F。有趣的是,這種替換未導致顯著受損的酶活性,但就Km值而言產生與野生型酶相同的結果,且比活性略有降低(見表2)。
Y165顯然對酶活性不如其他Cdo同源物中相應殘基重要,且可能它在Msdo中不是催化三聯體的一部分,因為它的缺失可以被補償,暗示該氨基酸殘基對Msdo活性非關鍵,與Cdo活性相反。Msdo中唯一的半胱氨酸被突變為絲氨酸殘基,產生變體MsdoC100S。該變體完全失活,表明該殘基對酶活性重要。由于該半胱氨酸是Msdo中唯一的半胱氨酸,其缺失可能導致結構變化,從而影響酶活性。在人類Cdo中,C100被絲氨酸取代,但該殘基在Msdo中可能對蛋白質折疊和resulting酶活性重要。
本研究中獲得的Msdo野生型酶動力學數據(Km 0.06 mM,Vmax 14.68μmol min?1mg?1,kcat 5.61 s?1)與先前研究(Km 0.4 mM,Vmax 20.0μmol min?1mg?1,kcat 7.7 s?1)的差異很可能due to使用了不同的技術設備;即Unisense的OXMR氧傳感器與Rank Brothers Ltd.的Dual Digital Model 20氧電極。由于后一種設備中無需移除電極即可添加酶啟動反應,該方法應提供更準確的結果。
5.結論
本研究重點探究了Msdo蛋白中保守氨基酸殘基的關鍵作用。研究證實,H93、H95、H163和C100這四個高度保守的殘基至關重要——當這些殘基被替換時,酶活性會完全喪失。而R66的替換導致酶活性顯著下降,這印證了該位點可能參與輔因子配位的假說。Q64的替換雖然使Km值較野生型升高,但該氨基酸對Msdo活性并非必需。同樣,Y165被苯丙氨酸取代后酶活性未受影響,但這種改變可通過其他機制得到補償,這表明與Cdo活性不同,該氨基酸殘基對Msdo活性并非關鍵。下一步將解析Msdo的晶體結構,這將有助于驗證本研究關于Msdo活性位點結構特征及關鍵氨基酸在酶特異性和活性中作用的發現。