熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
摘要
硫醇雙加氧酶是一類非血紅素單核鐵蛋白,屬于杯蛋白超家族。2014年,科學(xué)家發(fā)現(xiàn)奇異變色桿菌B4的巰基琥珀酸雙加氧酶(Msdo)是另一種催化巰基琥珀酸(MS)轉(zhuǎn)化為琥珀酸和亞硫酸鹽的細(xì)菌半胱氨酸雙加氧酶(Cdo)同源物。為深入探究酶活性關(guān)鍵氨基酸殘基的作用機(jī)制,研究人員構(gòu)建并分析了七個(gè)酶變體:(i)三個(gè)變體分別將保守的組氨酸殘基H93和H95替換為亮氨酸,推測(cè)前者可能對(duì)鐵(II)輔因子的配位至關(guān)重要,后者則對(duì)底物在活性位點(diǎn)的定位起重要作用;而H163的替換同樣被證實(shí)為必需,但對(duì)應(yīng)的酶變體完全失活,證實(shí)了這些殘基對(duì)酶活性的關(guān)鍵作用;(ii)C100S突變同樣導(dǎo)致酶失活,表明該位點(diǎn)對(duì)蛋白質(zhì)的穩(wěn)定性或活性具有重要影響;(iii)對(duì)于真核生物Cdo,研究者推測(cè)其底物定位存在氫鍵網(wǎng)絡(luò),而Msdo中相應(yīng)的氨基酸殘基基本構(gòu)成該網(wǎng)絡(luò)。盡管MsdoQ64A突變體的Km值較野生型0.06 mM顯著升高至0.29 mM,但其特異性活性未見明顯變化。(四)MsdoR66A突變體即使在高酶量條件下仍表現(xiàn)出極低活性,表明該位點(diǎn)可能對(duì)催化作用至關(guān)重要。(五)Y165F突變體的特異性酶活性為10.22μmol min?1 mg?1 protein,Km值仍保持在0.06 mM,與野生型酶高度相似。該位點(diǎn)對(duì)應(yīng)人類Cdo的Y157,屬于催化三聯(lián)體結(jié)構(gòu)域,推測(cè)參與底物定位。值得注意的是,Msdo中可能由其他位點(diǎn)承擔(dān)類似功能,因?yàn)閅165缺失并未引發(fā)顯著影響。
1.引言
有機(jī)硫化合物巰基琥珀酸(MS)被廣泛應(yīng)用于各個(gè)領(lǐng)域,例如作為量子點(diǎn)的穩(wěn)定劑(量子點(diǎn)是醫(yī)學(xué)研究中特別重要的工具),或在頭發(fā)化妝品領(lǐng)域用于還原角蛋白以建立永久性波浪。此外,MS被討論作為合成聚硫酯(PTE)的有前途的前體底物候選物。PTE是不可生物降解的生物聚合物,由于其性質(zhì)如溶解性降低和熱穩(wěn)定性優(yōu)于更常見的聚羥基鏈烷酸酯生物聚合物,因此對(duì)潛在工業(yè)應(yīng)用感興趣。因此,在Variovorax paradoxus菌株B4中闡明了MS的細(xì)菌代謝,旨在鑒定一種可能適用于PTE生產(chǎn)的新菌株。V.paradoxus B4的巰基琥珀酸雙加氧酶(Msdo)被描述為一種新型細(xì)菌硫醇雙加氧酶,是該細(xì)菌中MS降解的關(guān)鍵酶。該酶催化MS的氧依賴性轉(zhuǎn)化為亞磺基琥珀酸,后者自發(fā)脫亞磺基生成琥珀酸和亞硫酸鹽。Msdo屬于杯蛋白超家族,其特征是共同的β-桶核心以及部分保守的杯蛋白motif。
在真核生物中,半胱氨酸雙加氧酶(Cdo)是杯蛋白超家族最重要的代表之一,它通過催化半胱氨酸不可逆轉(zhuǎn)化為半胱氨酸亞磺酸,對(duì)調(diào)節(jié)細(xì)胞內(nèi)半胱氨酸濃度至關(guān)重要。由于一些嚴(yán)重的神經(jīng)系統(tǒng)疾病與半胱氨酸濃度升高及由此導(dǎo)致的Cdo活性缺乏有關(guān),該酶在醫(yī)學(xué)研究中被廣泛研究。另一種硫醇雙加氧酶是真核生物半胱胺雙加氧酶,催化半胱胺轉(zhuǎn)化為亞牛磺酸。迄今為止,還鑒定和表征了幾種真細(xì)菌的Cdo同源物。V.paradoxus TBEA6、Advenella mimigardefordensis DPN7T、Pseudomonas aeruginosa和Ralstonia eutropha H16的Cdo同源物被研究并表征為3-巰基丙酸雙加氧酶(Mdo)。雖然V.paradoxus TBEA6和A.mimigardefordensis DPN7T的Mdo僅對(duì)3-巰基丙酸有活性,將其轉(zhuǎn)化為3-亞磺基丙酸,但P.aeruginosa和R.eutropha H16的Mdo還利用半胱氨酸作為底物,盡管速率顯著較低。
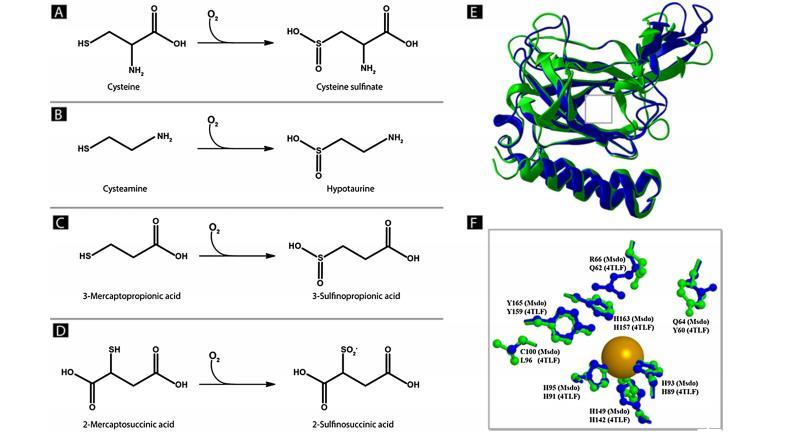
圖2顯示了硫醇雙加氧酶催化的反應(yīng)概述以及Msdo預(yù)測(cè)結(jié)構(gòu)與P.aeruginosa Mdo公開晶體結(jié)構(gòu)的結(jié)構(gòu)比對(duì)。
哺乳動(dòng)物和細(xì)菌Cdo及Cdo同源物的晶體結(jié)構(gòu)揭示了幾種高度保守的氨基酸殘基。例如,金屬離子輔因子由三個(gè)保守組氨酸殘基(3-His面部三聯(lián)體)配位。在真核生物Cdo中存在半胱氨酸-酪氨酸交聯(lián),這增加了酶活性但不存在于細(xì)菌Cdo中。由哺乳動(dòng)物Cdo的氨基酸殘基R60、Y58、H155和Y157形成氫鍵網(wǎng)絡(luò),這對(duì)半胱氨酸羧基在活性位點(diǎn)口袋中的定位至關(guān)重要。多重序列比對(duì)顯示這些殘基也存在于Msdo中:R66對(duì)應(yīng)哺乳動(dòng)物Cdo的R60,Y58在Msdo中被Q64取代,H163對(duì)應(yīng)H155,Y165是對(duì)應(yīng)人類Cdo Y157的殘基。
為了獲得對(duì)V.paradoxus B4新型硫醇雙加氧酶活性位點(diǎn)結(jié)構(gòu)的更深入了解,通過定點(diǎn)誘變生成酶變體并針對(duì)催化活性進(jìn)行表征。因此,參與鐵配位的三個(gè)組氨酸殘基中的兩個(gè)各被亮氨酸取代,產(chǎn)生酶變體MsdoH93L、MsdoH95L。可能參與氫鍵網(wǎng)絡(luò)的組氨酸也被亮氨酸殘基取代,產(chǎn)生變體MsdoH163L。此外,還生成了攜帶可能參與酶活性或結(jié)構(gòu)完整性的其他氨基酸殘基取代的變體:MsdoQ64A、MsdoR66A、MsdoC100S和MsdoY165F。
2.材料與方法
2.1.細(xì)菌菌株和生長(zhǎng)條件
本研究中使用的細(xì)菌菌株、質(zhì)粒和寡核苷酸(引物)列于表1。對(duì)于大腸桿菌菌株的培養(yǎng),細(xì)菌在液體或固體LB培養(yǎng)基中培養(yǎng),含有氨芐青霉素(75μg/ml),對(duì)于攜帶pLysS的菌株,額外添加氯霉素(34μg/ml)。
2.2.巰基琥珀酸雙加氧酶的定向誘變
對(duì)于巰基琥珀酸雙加氧酶的定向誘變,使用先前研究中生成的表達(dá)載體pET23a(+)::msdoB4作為PCR模板DNA。每種情況下,通過點(diǎn)突變將一個(gè)編碼特定氨基酸的靶DNA三聯(lián)體替換為替代三聯(lián)體,例如位置93的組氨酸被亮氨酸取代產(chǎn)生MsdoH93L。生成以下酶變體:MsdoQ64A、MsdoR66A、MsdoH93L、MsdoH95L、MsdoC100S、MsdoH163L和MsdoY165F。使用Phusion DNA聚合酶和補(bǔ)充有1%(v/v)DMSO的Phusion High Fidelity緩沖液進(jìn)行PCR擴(kuò)增。對(duì)于msdo的定點(diǎn)誘變以生成變體MsdoH93L、MsdoH95L、MsdoH163L和MsdoY165F,使用一個(gè)磷酸化引物和一個(gè)非磷酸化引物進(jìn)行擴(kuò)增。在98°C初始變性2分鐘后,樣品進(jìn)行30個(gè)循環(huán)的98°C變性20秒、60°C退火20秒和72°C延伸2.5分鐘,最后在72°C延伸5分鐘。對(duì)于其他變體的構(gòu)建,使用非磷酸化引物。對(duì)每個(gè)變體進(jìn)行梯度PCR(每個(gè)溫度一個(gè)反應(yīng)管)。為此,樣品在98°C初始變性30秒,然后進(jìn)行18個(gè)循環(huán)的98°C變性30秒、55-65°C退火1分鐘和72°C延伸5分鐘,最后在72°C延伸10分鐘。PCR后,將不同溫度的十個(gè)反應(yīng)管合并,樣品在37°C下用FastDigest DpnI處理15分鐘以去除甲基化模板DNA。所有獲得的PCR產(chǎn)物使用peqGOLD凝膠提取試劑盒按照制造商說明從瓊脂糖凝膠中純化。使用T4 DNA連接酶進(jìn)行連接。然后將獲得的質(zhì)粒用于轉(zhuǎn)化CaCl2-感受態(tài)大腸桿菌Top10細(xì)胞。通過質(zhì)粒DNA測(cè)序鑒定攜帶所需突變的正向克隆,測(cè)序由Seqlab進(jìn)行。然后用驗(yàn)證的質(zhì)粒轉(zhuǎn)化表達(dá)菌株大腸桿菌BL21(DE3)pLysS的CaCl2-感受態(tài)細(xì)胞。
 相關(guān)新聞
相關(guān)新聞