熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
摘要:
研究富氫鹽水(HRS)對腸缺血再灌注損傷(IIRI)大鼠腸上皮緊密連接(TJ)屏障的影響。將32只健康雄性Sprague-Dawley(SD)大鼠隨機分為四組(每組8只):Sham組、I/R組、HRS組和4-PBA組。缺血45分鐘和再灌注6小時后,大鼠被處死,收集血清和回腸進行檢測。用蘇木精和伊紅(H&E)染色觀察小腸形態。用酶聯免疫吸附試驗(ELISA)測定血清中腸脂肪酸結合蛋白(IFABP)、腫瘤壞死因子-α(TNF-α)和白細胞介素-1β(IL-1β)的表達水平。免疫組織化學、免疫熒光和Western印跡法用于檢測腸上皮TJ、ERS和ERS誘導細胞凋亡的關鍵蛋白,包括閉塞素、閉塞帶-1(ZO-1)、葡萄糖調節蛋白78(GRP78)、X-盒結合蛋白-1(XBP1)、C/EBP同源蛋白(CHOP)和Caspase-3。結果與I/R組大鼠相比,HRS組和4-PBA組大鼠回腸損傷的Chiu評分較低。各組大鼠血清IFABP、TNF-α和IL-1β水平差異有統計學意義。HRS組和4-PBA組通過降低ERS的各種參數增加了TJ蛋白閉塞素和ZO-1的表達,GRP78、XBP1、CHOP和caspase-3蛋白水平的下調證明了ERS誘導的細胞凋亡。結論HRS對IIRI大鼠的腸道屏障具有潛在的保護作用。本研究表明,HRS可抑制過量ERS和ERS誘導的細胞凋亡,從而減少腸道上皮細胞損傷,維持IIRI大鼠腸道上皮TJ屏障的完整性。
引言:
腸道缺血再灌注損傷(IIRI)是一個復雜的病理生理過程,常發生在腸套疊、中腸炎、腸系膜栓塞、壞死性小腸結腸炎、敗血癥、嚴重創傷和休克等急性重癥疾病中。腸梗阻綜合征導致腸上皮屏障功能障礙。腸上皮屏障由上皮細胞和細胞間緊密連接(TJ)組成,是防止有害細菌和毒素通過腸粘膜進入血液和遠處組織或器官的結構和功能的總和。缺血再灌注造成的腸上皮細胞損傷嚴重影響了腸上皮TJ屏障的完整性。選擇性調節可滲透物質大小和電荷的TJ是腸上皮屏障的重要結構基礎。減少腸上皮細胞損傷以維持腸上皮TJ屏障完整性的策略可以緩解IIRI。有證據有力地表明,內質網應激(ERS)是缺血再灌注損傷(IRI)的一個主要因素。ERS是介導腸上皮細胞凋亡的重要機制之一。最近的研究發現,氫氣通過抑制ERS和ERS誘導的細胞凋亡可以緩解不同組織或器官的IRI,如海馬、大腦和肝臟。氫氣通過抗氧化、抗炎和其他生物效應緩解IRI。然而,氫氣對IIRI大鼠腸上皮TJ屏障的影響仍不清楚。我們推測,應用氫氣的富氫生理鹽水(HRS)可通過抑制ERS和ERS誘導的細胞凋亡來保護腸上皮屏障的完整性,從而減少IRI。本研究將證明這一假設。同時,使用ERS抑制劑4-苯基丁酸(4-PBA)作為陽性對照。
材料與方法:
動物:
研究前已獲得濱州醫科大學附屬醫院倫理委員會的批準。32只8周齡的健康雄性Sprague-Dawley大鼠每籠4只為一組。這些大鼠在恒定的室溫和濕度下飼養,12小時光暗交替。在麻醉前12小時之前不限制食物或水的供應。
制備和測定富氫鹽水:
將氫氣發生器產生的氫氣注入袋裝生理鹽水中,壓力約為0.3兆帕,輸出流量為300毫升/分鐘。重復上述步驟三次后,將得到的氫氣溶液置于4°C冰箱中備用。過飽和氫溶液(0.6mmol/L)由便攜式溶解氫測量儀(Unisense,丹麥)檢測。
實驗設計和手術過程:
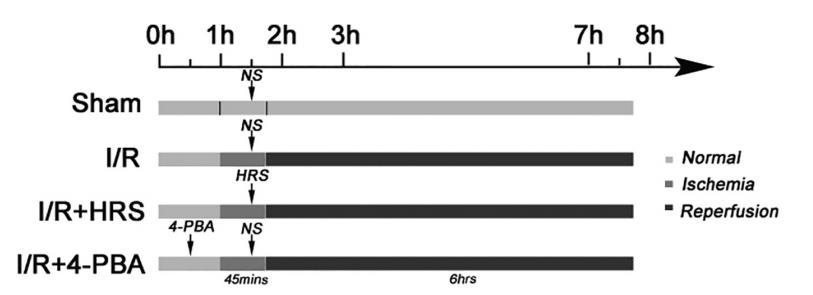
32只大鼠被隨機分為四組(每組n=8),如圖1所示:Sham組、I/R組、HRS組和4-PBA組。IIRI大鼠參照Megison描述的方法建立。用無創動脈夾夾住SMA,誘導缺血45分鐘,然后再灌注6小時。每只大鼠腹腔注射3ml/kg10%水合氯醛進行麻醉。操作過程中應注意無菌操作。
樣品采集:
再灌注6小時后再次對大鼠進行麻醉。我們沿原切口進入腹腔采集樣本。從下腔靜脈采集約3-4毫升血液,室溫放置30分鐘后離心10分鐘(4°C,3000g/分鐘)。血清樣本在-20°C下保存,以備日后批量分析腸粘膜損傷和細胞因子檢測。采集回腸組織樣本并用冷生理鹽水反復沖洗。標本任選其一:1)用4%多聚甲醛溶液固定,蔗糖梯度脫水,用最佳切割溫度化合物包埋,切成6μm厚的切片用于組織形態學研究;或2)立即用液氮冷凍,然后保存在-80°C,用于以后的蛋白質檢測分析。
組織病理學分析:
切片采用改良蘇木精和伊紅(H&E)染色試劑盒染色。在顯微鏡下觀察回腸的組織學變化。根據Chiu評分,回腸損傷程度分為0至5級。兩名病理學家以盲法評估樣本的組織損傷情況。
酶聯免疫吸附試驗(ELISA):
血清中的腸脂肪酸結合蛋白(IFABP)、腫瘤壞死因子-α(TNF-α)和白細胞介素-1β(IL-1β)水平用ELISA試劑盒測定,單位為納克/毫升或納克/升。
免疫組織化學(IHC):
冷凍切片恢復室溫后,使用IHC試劑盒進行染色。為了驗證抗體的特異性,實驗中加入了不含一抗的陰性對照。用光學顯微鏡觀察切片,并用ImageJ軟件進行量化。
免疫熒光(IF):
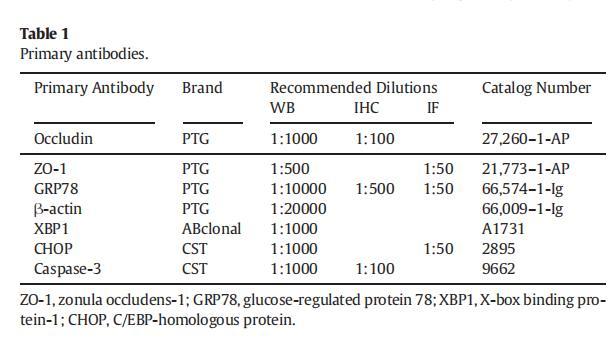
將冷凍切片恢復至室溫后,用QuickBlock?孵育10分鐘以阻斷非特異性反應。一抗(表1)4℃孵育過夜后,用PBS沖洗切片,然后加入Coralite488-Goat抗小鼠或兔IgG二抗(稀釋度1:200)室溫暗處孵育1小時。用熒光顯微鏡觀察切片。