熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
摘要
實體瘤中的缺氧仍然是傳統癌癥療法面臨的一個挑戰。作為抗藥性、轉移發展和藥物生物加工的來源,它影響著治療效果和疾病預后。生物還原性鉑(IV)原藥可能比傳統的金屬療法更具優勢,因為在還原性環境(如缺氧環境)中進行生物轉化是藥物活化的必要條件。本研究分兩步篩選了具有不同還原率和親脂性的實驗性鉑(IV)原藥,目的是找出最合適的化合物進行進一步研究。第一步,利用一組對鉑(II)化合物具有不同敏感性的癌細胞系,在缺氧多細胞球和單層培養中比較所有化合物的細胞毒性。其次,在SCID小鼠模型的缺氧異種移植物中測試了兩種所選化合物與沙鉑的比較,此外,還對這些化合物在缺氧球體和異種移植物中進行了基于(LA)-ICP-MS的積累和分布研究。我們的研究結果表明,雖然細胞攝取和細胞毒性與親脂性密切相關,但與非缺氧條件相比,鉑(IV)原藥在缺氧條件下的細胞毒性和抗腫瘤活性取決于它們的還原率。
引言
順鉑自20世紀70年代末被批準用于癌癥治療以來,一直被廣泛使用,因此常被稱為"癌癥青霉素"。這種化療藥物的持續成功激發了用于抗癌治療的鉑(II)化合物的進一步發展,產生了數百種順鉑類似物。除順鉑外,奧沙利鉑和卡鉑是唯一廣泛應用于臨床的金屬基抗癌藥物,而其他藥物,如皮鉑,目前正在進行臨床試驗。然而,鉑療法的主要局限性依然存在,如耐藥性的產生和劑量限制性副作用。為了克服順鉑治療的弊端,人們嘗試探索鉑(IV)化合物。以鉑(IV)為基礎的原藥中最突出的代表—沙鉑,作為不同癌癥類型的單一療法和聯合療法,正在進行不同的I、II和III期臨床試驗,但與標準療法相比,大多數試驗都顯示出中等或較低的活性。然而,鉑(IV)復合物是很有前途的抗癌藥物,因為它們具有高穩定性和生物利用度,可以口服應用并克服腎毒性等副作用。鉑(IV)絡合物必須通過還原激活才能釋放出其活性鉑(II)代謝物。因此,鉑(IV)復合物作為生物還原性原藥,可用于治療缺氧,縮小傳統金屬療法和靶向療法之間的差距。
缺氧是進展期實體瘤的一個重要特征,幾十年來一直是傳統抗癌療法面臨的挑戰。由于包括鉑(II)類藥物在內的大多數化療藥物都以高度增殖的癌細胞為目標,通常與缺氧相關的強大靜止細胞部分幾乎不受許多治療方法的影響。此外,壞死和缺氧區域會在腫瘤組織中產生不均勻性,其物理化學和生物學特性也會發生變化,如pH和pO2梯度以及不同的蛋白質表達模式。這種生物還原環境會影響化療藥物的穩定性,并導致這些藥物發生特定的生物轉化。在這種情況下,鉑(IV)復合物可能比其他治療方法更具優勢,因為鉑(IV)復合物必須先還原才能激活藥物。然而,迄今為止,有關鉑(IV)在缺氧腫瘤中的活化情況的研究還很少。
Hall等人和Mellor等人認為,鉑(IV)絡合物在實體瘤條件下可能被還原成具有活性的鉑(II)對應物。不同的小分子量還原劑,如抗壞血酸、谷胱甘肽或氨基酸,如L-蛋氨酸和L-半胱氨酸,以及蛋白質,如金屬硫蛋白和白蛋白,都被認為是體內和體外細胞內和細胞外還原的原因。然而,鉑(IV)還原的確切機制仍不清楚,試圖研究腫瘤微環境對鉑(IV)復合物穩定性的影響也沒有完全得出結論。盡管如此,鉑(IV)化合物在實體瘤缺氧條件下可能被還原的假說仍在討論之中,而這一假說的證實還需要更多的實驗證據。
本研究特別考察了缺氧對三種在研鉑(IV)化合物、其主要鉑(II)代謝物以及作為參考化合物的沙鉑在不同人體和體外人類癌癥模型中活性的影響(圖1)。
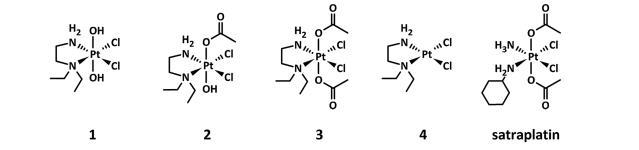
圖1、正在研究的鉑(IV)復合物1-3的化學結構,包括作為主要鉑(II)代謝物4和參考化合物satraplatin。
所研究的鉑(IV)配合物具有相同的赤道配體球,而它們的軸配體則不同,1、2和3的配體分別為反式二羥基、反式二羥基乙酰基和反式二乙酰基。配體球的變化與抗壞血酸和谷胱甘肽存在時的還原率、還原電位和親脂性不同有關,而可能的鉑(II)代謝物和穩定性則相當。這一系列理化性質使這些化合物非常適合作為模型配合物,用于研究在缺氧條件下還原速率對鉑(IV)藥物抗增殖活性的影響。
首先,在單層和缺氧多細胞球狀模型中測試了研究用復合物1-3,以了解其細胞毒性效力對所用細胞培養條件的依賴性。隨后,化合物1和2(相對于單層培養物而言,在缺氧球形體中表現最佳)在非缺氧球形體模型、缺氧單層模型和雄性SCID小鼠模型中進行了進一步測試。此外,鉑在球體內的分布和細胞積累研究進一步揭示了化合物的行為及其作用模式。
材料與方法
細胞系和培養條件
人類細胞系CH1(通過STR圖譜鑒定為Multiplexion的PA-1卵巢畸胎癌細胞)和結腸癌細胞系HCT116(ATCCs CCL-247t)在MEM(補充10%熱滅活胎牛血清、1%L-谷氨酰胺、1%丙酮酸鈉、1%非必需氨基酸溶液)中生長。人HT1080(ATCCs CCL-121t)纖維肉瘤細胞和CCD-18Co正常結腸成纖維細胞保存在添加10%FCS的MEM(Sigma)中。所有細胞系的單層培養物均生長在經細胞培養處理的75cm2燒瓶中。
球形體培養
對于球形細胞的生產,CH1/PA-1、HCT116和HT1080細胞經胰蛋白酶化從培養瓶中收獲,并在MEM中播種,使用未經細胞培養處理的圓底96孔板(VWR),對于處理前7天直徑大于400微米的球形細胞,其密度分別為每孔1×104個(CH1/PA-1)、2×103個(HCT116)和8×103個(HT1080);對于處理前3天直徑小于200微米的球形細胞,其密度分別為每孔1×103個(CH1/PA-1)、0.3×103個(HCT116)和0.3×103個(HT1080)。3×103(HCT116)、0.3×103(HT1080)個有活力細胞。為盡量減少蒸發,最外層的孔不用于球形細胞的培養,而是注入200mL的PBS。培養物在37攝氏度、含95%空氣和5%CO2的濕潤環境中培養。
 相關新聞
相關新聞