熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
結果與討論
球體內缺氧特征
球形體是一種體外腫瘤模型,與體內腫瘤有一些共同特征,如增殖和營養梯度、慢性缺氧和壞死。以前曾分別用HIF-1a免疫熒光法和PI染色法觀察過直徑為>400μm的球體(又稱"缺氧球體"或"缺氧3D球體")的缺氧區域和壞死核心。獲得的圖像顯示球核內有大量壞死,并顯示輕度缺氧區域從球表面下30毫米的深度開始。然而,直徑為200微米以下的球體沒有缺氧或壞死的跡象,因此被稱為"非缺氧球體或非缺氧3D"。
現在繼續對活體球體內的缺氧環境進行表征。為此,采用侵入式微電極技術測量了大于400μm大球體內的氧氣分布。其他作者發表的用微電極測量活體球體內氧分壓的嘗試遇到了一些技術問題,并提出了需要批判性討論的問題。例如,Mueller-Klieser等人報告的穩態測量每步耗時1分鐘,每個球體的總測量時間為20分鐘。在這段時間內,被動擴散很可能會影響數據。為了繞過這個問題,我們使用了新型技術設備,每步測量可在4秒內完成,每個球面的總測量時間約為1.5分鐘。
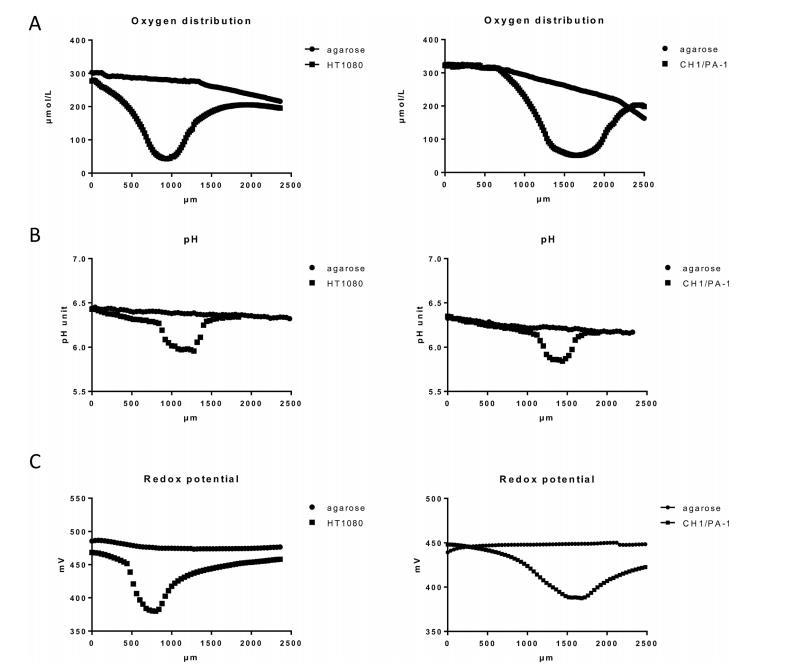
圖2、通過瓊脂糖包埋的HT1080和CH1/PA-1多細胞球體(直徑>400μm)與遠離球體的瓊脂糖培養基的物理化學梯度比較,由微電極測量并以代表性樣本為例。(A)氧分布(以20μm為間隔測量),(B)pH值(以40μm為間隔測量),(C)氧化還原電位(以40μm為間隔測量)。剖面深度是相對于瓊脂糖表面而言的,因此球體相對于瓊脂糖表面的位置各不相同。
如HT1080和CH1/PA-1球形細胞所示(圖2A和ESI?),我們的研究結果表明,氧梯度向球形細胞壞死核心移動,球形細胞中心的氧分壓最低。這些結果與其他作者發表的數據非常吻合。對所有調查的細胞系和樣本(每個細胞系至少9個樣本)都監測到了相似的模式;但觀察到絕對值因細胞系而異,因此也因球形體的緊密度而異,而且同一細胞系的球形體之間也存在個體差異。圖2顯示了HT1080和CH1/PA-1球形細胞的示例結果。實驗裝置要求固定樣本并保持濕度和溫度;為此,樣本被嵌入瓊脂糖中。球體周圍的氧含量已明顯下降,但不含球體的瓊脂糖剖面測量結果(此處用作陰性對照)卻沒有出現這種情況,該結果僅顯示瓊脂糖深層的氧含量下降非常緩慢。
缺氧通常伴隨著pH值的顯著下降(酸中毒),這在實體瘤和多細胞球體內經常可以觀察到。由于pH值是影響大多數化療藥物穩定性的一個主要因素,我們采用微電極法研究了樣本中是否存在pH值梯度以及在多大程度上可以測量到這種梯度。結果表明,pH梯度沿氧分布模式向球形中心延伸,但幾乎沒有向球形周圍延伸(圖2B和ESI?)。觀察到的球形體表面與球形體中心之間的pH值差約為0.2個pH單位,這與其他作者之前發表的結果非常吻合。pH值曲線可大致反映出球形體的尺寸(>400μm),而氧氣梯度更平坦,且更多地延伸到周圍的瓊脂糖中,這很可能是由于有活力的球形體持續消耗氧氣后產生的擴散作用。
此外,據報道,缺氧會導致單層生長的癌細胞的還原電位顯著下降。雖然預計球核中的大量缺氧也會導致還原電位顯著下降,但迄今為止還沒有相關測量報告。為了評估所使用的球粒模型中的氧化還原電位,我們在活體球粒中進行了微電極測量。我們的數據顯示,氧化還原電位向球體中心顯著下降,這與氧氣和pH值的分布模式相似(圖2C和ESI?)。遺憾的是,實驗裝置無法區分細胞內和細胞外區域。總體而言,氧含量、pH值和還原電位的降低強調了球體內還原環境的存在,其中以壞死核心最為明顯(圖2和ESI?)。
抗增殖活性
研究癌癥細胞系的抗增殖活性是探索實驗化合物抗癌潛力的關鍵第一步。因此,我們使用對鉑(II)類藥物敏感性不同的細胞系,包括CH1/PA-1卵巢畸胎癌(最敏感)、HCT116結腸癌(中度敏感)和HT1080纖維肉瘤(不敏感)細胞,在不同的缺氧和非缺氧細胞培養模型中研究了化合物1-4和沙鉑的細胞毒性,并將它們與奧沙利鉑(l-OHP)(之前發表的數據)進行了比較。第一步,通過阿拉瑪藍檢測法確定缺氧球形細胞和非缺氧單層培養細胞的IC50值。在非缺氧單層培養物中,所有復合物對敏感細胞株CH1/PA-1的活性最高,IC50值大多在低微摩爾范圍內,而對耐藥細胞株HT1080的活性最低。一般來說,復合物在所有三種細胞系中的活性按以下順序增加:1<4<2<3<沙鉑<l-OHP,表明參考化合物沙鉑和奧沙利鉑在單層培養中的細胞毒性最強。研究化合物1-3的順序與這些物質的親脂性非常吻合,1的親脂性最小,3的親脂性最大。這些數據與之前公布的結果非常吻合。在CH1/PA-1細胞系中的數值與參考文獻38中公布的數值略有不同,這可能是由于使用了一種名為"CH1/PA-1"的藥物。38中的數值略有不同,這可能是由于使用了不同的試劑對有活力的細胞進行染色(MTT與阿拉瑪藍)。
在缺氧球體(3D)模型(直徑為>400μm的球體,HIF1a和PI染色陽性)中,細胞毒性的程度因化合物而異。在CH1/PA-1球形模型中,化合物1-4的活性轉移到更低的IC50值,而沙鉑和奧沙利鉑則受到負面影響。這些結果突顯了細胞系CH1/PA-1的敏感性,因為在敏感性較低的細胞系HT1080和HCT116中,大多數IC50值都會升高,只有HT1080細胞中的1例外。在比較三維CH1/PA-1模型中獲得的結果和還原速度時,可以明顯看出,還原速度較慢的物質1(系數6.8)的細胞毒性效力最大,而還原速度較快的物質2和3(系數分別為1.6和1.7)在缺氧條件下只顯示出輕微的激活作用。雖然在敏感性較低的細胞系HT1080和HCT116中,所有細胞毒性效力都受到了負面影響,但各因子的下降順序相似:1(因子1.3和0.6)>2(因子0.7和0.3)>3(因子0.4和0.1)。
令人驚訝的是,鉑(II)物種(4)在CH1/PA-1球形模型中顯示出1.6倍的活化作用,而沙鉑和奧沙利鉑的細胞毒性則有所減弱。由于該化合物中的鉑已經處于活性較高的氧化態+II,因此在CH1/PA-1模型中觀察到的復合物4的活化現象無法用還原來解釋。但值得注意的是,鉑(II)參比化合物奧沙利鉑(l-OHP)并沒有表現出類似的活化作用。奧沙利鉑和4之間最重要的結構差異在于離去基團:一個草酸螯合基團,而不是兩個氯化物。在鉑(II)中心與DNA結合之前,這些初始配體必須通過水合作用釋放出來。因此,受這些配體影響的吸水速率可能是復合物4活化的一個可能原因。Knox等人之前發表的研究結果支持了這一假設,即順鉑的水解速度是奧沙利鉑的112倍。此外,pH值以及三維模型中的pH值梯度對鉑(II)的水解過程及隨后的DNA結合至關重要,因為有報道稱,當pH值大于8時,水溶液會轉化為活性較低的羥基,而pH值小于8時,結合動力學會增加。
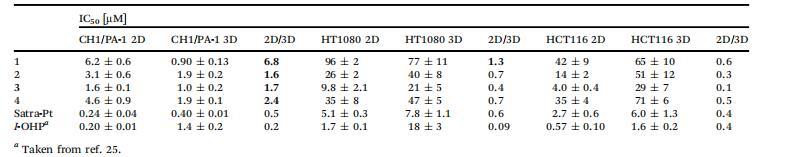
表1、復合物1-4、沙鉑和奧沙利鉑(l-OHP)在缺氧球狀(三維)模型和非缺氧單層(二維)模型中的細胞毒性,通過阿拉瑪藍檢測法測定(暴露時間96小時)。
由于奧沙利鉑作為鉑(II)參比化合物,在三維實驗中的細胞毒性與二維實驗中的細胞毒性相比,IC50值增加了10倍(表1),因此我們假設,觀察到的鉑(IV)原藥細胞毒性活性的增加可能反映了它們被還原激活。為了支持這一觀點,我們選擇了化合物1(還原率和親脂性最低)和化合物2(還原率和親脂性居中),它們是在所有研究細胞系的缺氧球形體中按活化順序排列的表現最好的化合物,因此我們選擇它們在非缺氧球形體、缺氧單層培養以及缺氧異種移植中進行進一步研究。
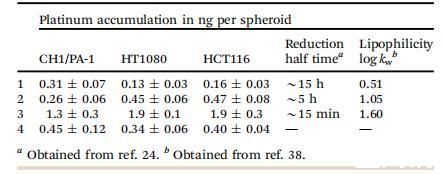
表2、化合物1和2在缺氧與非缺氧球體以及缺氧與非缺氧單層培養中的細胞毒性
出乎意料的是,單層培養中的缺氧不會引起敏感細胞株CH1/PA-1中化合物的活化,而在不太敏感的細胞株HT1080和HCT116中IC50值會增加,與缺氧球形培養中的IC50值相當(圖3和表2)。這些結果凸顯了單層培養和球形培養中缺氧的區別,單層培養細胞得到適當的營養供應,對缺氧表現出早期反應,但沒有壞死或凋亡的跡象,也沒有其他pH分布和蛋白質表達模式。
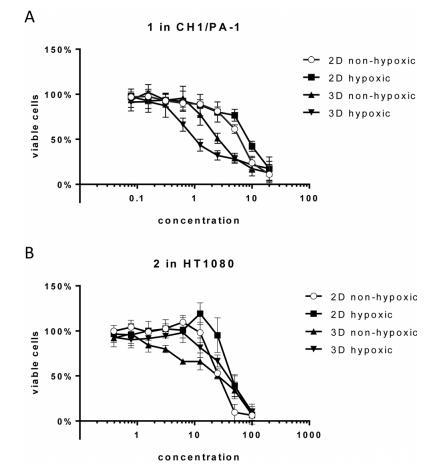
圖3、化合物1和2在缺氧與非缺氧球形細胞和缺氧與非缺氧單層細胞中的細胞毒性。(A)1在CH1/PA-1細胞中的濃度效應曲線。(B)2在HT1080細胞中的濃度效應曲線。
在CH1/PA-1的非缺氧球形模型(直徑為約200毫米的球形體,HIF1a和PI染色陰性)中,1的IC50值介于單層培養和缺氧球形體中的IC50值之間(缺氧2D>非缺氧2D>非缺氧3D>缺氧3D)(圖3)。與單層培養相比,2在缺氧和非缺氧CH1/PA-1球體內的IC50值相當,表明這兩種化合物在兩種球體模型中都有活化作用(表2)。1和2在非缺氧HT1080球形細胞中的情況也是如此,后者的IC50值與缺氧球形模型中的IC50值相當。然而,在HCT116細胞中,非缺氧球形細胞中的IC50值與單層培養中的IC50值相當。總的來說,這些觀察結果與在低氧球形培養基中獲得的結果一致,再次表明與HCT116和HT1080細胞相比,CH1/PA-1細胞具有較高的敏感性,而且活化順序相似:1≥2。
 相關新聞
相關新聞