熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
2.2.批式實驗
2.2.1.批式反應器
使用兩種類型的批式反應器進行批式測試1和2。兩者均為可密封反應器,工作體積分別為0.36L和1.3L。每次批式測試開始前,反應器先充入從母反應器缺氧階段結束時取出的混合液,然后通入N2氣體5分鐘以確保缺氧條件。所有批式測試中pH通過添加0.5M HCl或0.5M NaOH溶液控制在預設值±0.05范圍內(見下文)。所有測試在室溫(22.0–23.0°C)下進行。
2.2.2.批式測試1:pH對硝酸鹽、亞硝酸鹽和N2O還原的影響
在360mL批式反應器中于pH 6.0、6.5、7.0、7.5、8.0、8.5和9.0下進行批式測試。每次測試開始時,添加硝酸鹽、亞硝酸鹽或N2O儲備液使初始濃度高于15mg N/L。N2O儲備液通過將Milli-Q水用100%N2O氣體吹掃5分鐘制備,每次實驗前新鮮制備(Zhou et al.,2008)。然后向批式反應器中注入甲醇使初始COD:N比為5:1。每次實驗持續20分鐘。每5分鐘取混合液樣品用于硝酸鹽和亞硝酸鹽分析。使用微傳感器在線連續監測溶解N2O(見2.4節)。每次實驗結束時三次測量MLVSS濃度。
2.2.3.批式測試2:pH對N2O積累的影響
在1.3L批式反應器中于與批式測試1相同的pH范圍內進行多項批式測試。每次測試中初始硝酸鹽和甲醇濃度分別設為160mg NO??-N/L和240mg COD/L,以確保:(1)甲醇氧化持續1–2小時,從而可檢測到N2O積累趨勢;(2)甲醇在硝酸鹽耗盡前耗盡,導致內源期。每次實驗持續300分鐘。使用在線傳感器監測硝酸鹽和N2O(見2.4節)。每30分鐘取混合液樣品用于硝酸鹽、亞硝酸鹽和甲醇分析。每次實驗結束時三次測量MLVSS。
2.3.母SBR在不同pH水平下的N2O產生
在母SBR中應用兩種不同pH條件:pH 6.0±0.1和pH 7.2±0.1(后者為母SBR的平均pH)。pH通過PLC自動控制,如2.1節所述。每種情況下使用微傳感器連續監測液相N2O濃度5天(見2.4節)。
2.4.取樣與分析方法
使用注射器取混合液樣品并立即通過一次性Millipore濾器(0.22μm孔徑)過濾,用于亞硝酸鹽、硝酸鹽、銨、磷酸鹽和甲醇分析。使用Lachat QuikChem8000流動注射分析儀(Lachat Instrument,Milwaukee,Wisconsin)分析銨(NH?-N)、硝酸鹽(NO?-N)、亞硝酸鹽(NO?-N)和正磷酸鹽(PO?3?-P)濃度。使用氣相色譜(Perkin Elmer Autosystem)分析甲醇。每次批式實驗結束時三次測量MLSS和MLVSS(APHA,1995)。使用N2O微電極(N2O-100,水中檢測限0.0028mg N2O-N/L,Unisense A/S,Aarhus,Denmark)在線測量液相N2O。該傳感器信號在水中0–33.2mg N2O-N/L范圍內線性響應(Andersen et al.,2001),響應時間小于10秒。每次實驗前校準傳感器。批式測試2中的硝酸鹽濃度和pH使用YSI硝酸鹽傳感器和YSI pH傳感器(YSI Professional Plus,United States)在線測量。硝酸鹽傳感器工作范圍為0–200mg NO??-N/L。每次批式實驗前校準硝酸鹽和pH電極。
2.5.動力學分析
在批式測試1中,甲醇過量供應。因此,硝酸鹽、亞硝酸鹽和N2O還原不受碳源限制。thus,通過硝酸鹽和亞硝酸鹽曲線的線性回歸確定最大硝酸鹽和亞硝酸鹽還原速率。通過將上述確定的速率數據除以測量的MLVSS濃度(三次平均值)確定生物量特異性硝酸鹽和亞硝酸鹽還原速率。
由于碳源過量,N2O還原動力學預期遵循Monod方程:
[r_{N_2O}=k_{m,N_2O}frac{S_{N_2O}}{K_{S,N_2O}+S_{N_2O}}X]
其中r_{N_2O}為N2O還原速率(mg N?O-N/(L·小時)),k_{m,N_2O}為最大生物量特異性N2O還原速率(mg N?O-N/(g MLVSS·小時)),S_{N_2O}為N2O濃度(mg N?O-N/L),K_{S,N_2O}為半飽和系數(mg N?O-N/L),X為生物量濃度(g MLVSS/L)。
使用以下一階方程考慮N2O微傳感器的動力學:
[taufrac{dy(t)}{dt}=-y(t)+mu(t)]
其中τ為時間常數(通過階躍測試確定為5.9秒,Smith and Corripio,2006),y(t)為t時刻測量的N2O濃度,μ(t)為t時刻真實N2O濃度。
通過將模型預測的N2O數據(考慮N2O消耗反應(方程1)和傳感器動力學(方程2))與連續測量的N2O數據擬合,使用最小二乘法(Smith et al.,1998)估計最大N2O還原速率k_{m,N_2O}和半飽和系數K_{S,N_2O}。通過計算單個參數估計的95%置信區間和參數組合的聯合置信區域(Batstone et al.,2003)研究參數可識別性。使用Aquasim 2.1d中參數估計程序的修改版本進行參數估計(Reichert,1994)。通過將k_{m,N_2O}值除以測量的MLVSS濃度確定最大生物量特異性N2O還原速率。
2.6.建模
在Aquasim中實施Hiatt and Grady(2008)的氮活化污泥模型(ASMN)以預測批式測試2中反硝化過程中N2O積累的趨勢。ASMN模型描述了碳氧化、硝化和反硝化。在ASMN中,反硝化通過四個獨立的過程速率方程建模,分別描述使用硝酸鹽、亞硝酸鹽、一氧化氮和氧化亞氮作為末端電子受體的缺氧異養生長。建模工作的目的是驗證觀察到的硝酸鹽還原過程中N2O積累是否可以通過ASMN模型正確預測,該模型將反硝化的四個步驟建模為獨立過程。模擬研究中使用從批式測試1確定的動力學參數。其他參數使用Hiatt and Grady(2008)推薦的值而未進一步校準,因為模擬與測量數據的比較僅基于總體趨勢。
3.結果
3.1.pH對硝酸鹽、亞硝酸鹽和N2O還原的影響
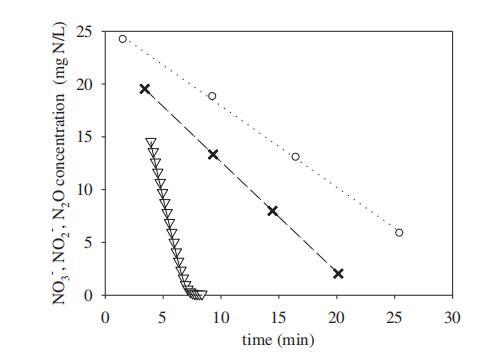
通過批式測試1研究了pH對硝酸鹽、亞硝酸鹽和N2O還原的影響。作為示例,圖1顯示了在pH 8.0下三個批式實驗中測量的硝酸鹽、亞硝酸鹽和N2O曲線。這些曲線以及測量的MLVSS濃度允許使用2.5節描述的方法確定最大生物量特異性硝酸鹽、亞硝酸鹽和N2O還原速率。這些結果總結于圖2,與k_{m,N_2O}相關的誤差棒表示參數估計程序產生的估計標準誤差。
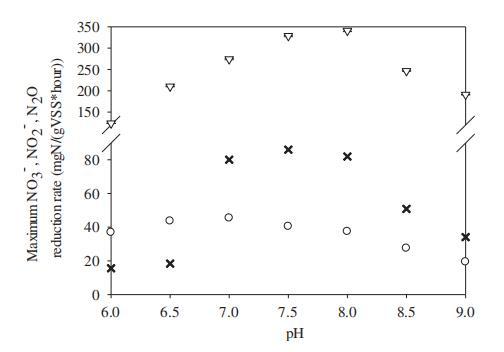
如圖2所示,在研究的pH范圍6.0–9.0內,最大生物量特異性N2O還原速率(k_{m,N_2O})強烈依賴于pH,其值從pH 6.0時的120mg N/(gVSS·小時)逐漸增加至pH 8.0時的340mg N/(gVSS·小時),然后在pH 9.0時降至190mg N/(gVSS·小時)。最大生物量特異性硝酸鹽和亞硝酸鹽還原速率隨pH變化呈現類似趨勢。然而,硝酸鹽和亞硝酸鹽還原速率遠低于相同pH水平下的N2O還原速率。最高硝酸鹽還原速率為45mg N/(gVSS·小時)(pH 7.0),而最高亞硝酸鹽還原速率為86mg N/(gVSS·小時)(pH 7.5)。
與硝酸鹽和亞硝酸鹽還原相比,N2O還原速率對pH變化更為敏感。在最低pH水平(pH=6.0),N2O還原速率較pH 8.0時的最高水平下降了65%。相比之下,在pH 6.0時,硝酸鹽還原速率僅較其最高水平下降了17%。亞硝酸鹽還原速率在pH 6.5和6.0時的急劇下降可能由于游離亞硝酸(FNA)抑制。為確保亞硝酸鹽不限制亞硝酸鹽還原速率,初始亞硝酸鹽濃度為30mg NO?-N/L。在pH 6.5和6.0時,這將導致室溫下FNA濃度分別為0.02mg HNO?-N/L和0.07mg HNO?-N/L。這些濃度處于先前發現抑制亞硝酸鹽還原的FNA范圍內(Zhou et al.,2007)。這一假設得到以下事實支持:在這些pH水平下硝酸鹽還原期間無亞硝酸鹽積累(數據未顯示),表明無FNA抑制時的最大亞硝酸鹽還原速率將高于或至少等于pH 6.0和6.5時的硝酸鹽還原速率。
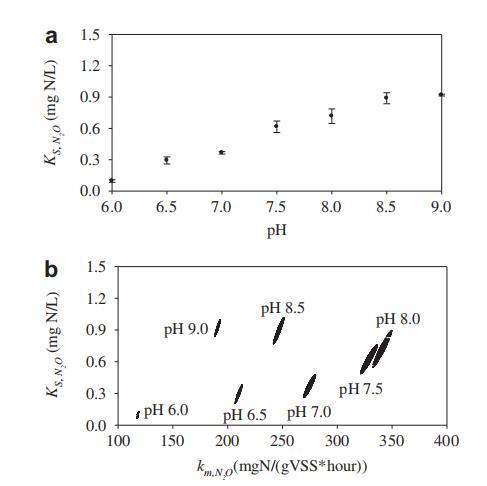
在pH 6.0、6.5、7.0、7.5、8.0、8.5和9.0下估計的N2O還原的K_{S,N_2O}值顯示于圖3a,誤差棒表示標準誤差。K_{S,N_2O}值從pH 6.0時的0.10mg N?O-N/L增加至pH 9.0時的0.92mg N?O-N/L。這些結果表明Nos對N2O的親和力受pH極大影響,較低pH增強親和力。K_{S,N_2O}和k_{m,N_2O}估計的95%置信區域(圖3b)均較小且彼此無重疊,表明不同pH水平的估計參數集在統計上均不同。
 相關新聞
相關新聞