熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
氧化應激的評估。用RT-PCR分析標記基因表達的技術已在前文詳細描述。使用Trizol試劑從間歇性缺氧或常氧下的小鼠睪丸中提取總RNA,提取方法按照生產商的說明進行了一些修改。隨即,按照生產商的說明進行實時反應;在提取信使RNA(mRNA)時加入0.2mM oligo(dT)、0.5mM隨機引物,并在70℃下加熱5分鐘。然后,熱變性(65℃,2分鐘),42℃下反向轉錄60分鐘,70℃下滅活10分鐘,最終體積為40μL,其中含有每種dNTP 0.5mM、M-MLV RT(0.5μL)、RNasin(0.2μL)和含8mM二硫蘇糖醇(DTT)的10×M-MLV RT緩沖液。使用Rotorgene 6000 Real Time CyclerTM和SYBR Green作為雙鏈DNA特異性熒光染料,通過實時定量(q)RT-PCR對所有mRNA轉錄本進行定量。
在PCR混合液中加入每個樣本的2μL等分試樣,混合液中含有特定引物,用于擴增3-磷酸甘油醛脫氫酶(GAPDH)(5′-AGGTCGGTGTGAACGGATTTG和5′-TGTAGACCATGTAGTTGAGGTCA)和谷胱甘肽過氧化物酶1(Gpx1)(5′-GCAACCAGTTTGGGCATCA和5′-CTCGCACTTTTCGAAGCATA)、谷胱甘肽過氧化物酶1(Gpx1)(5′-GCAACCAGTTTGGGCATCA和5′-CTCGCACTTTTCGA AGCATA)、和超氧化物歧化酶1(Sod1)(5′-GTGCAAGGCACCATCCACTTCG和5′-CACCATCGTGCGCCAATGATG和過氧化氫酶(Cat)(5′-CCGACCAGGGCATCAAAA和5′-GAGGCCATAATCCGGATCTTC)。PCR程序包括94℃(2分鐘)的初始步驟,然后是94℃(15秒)、56℃(30秒)和72℃(30秒)的35個循環。熔解方案包括在40℃下保持60秒,然后從50℃加熱到94℃,在每個溫度下保持5秒,同時監測熒光。在qRT-PCR中,我們使用了六組(缺氧)和五組(對照)互補DNA,對所有相關基因進行了兩次重復。作為陰性對照,我們始終提供水樣。比較周期閾值(CT)法用于量化表達水平。
定量與內源性對照GAPDH進行歸一化。在每個循環中采集熒光,以確定閾值循環或反應對數線性階段的循環,在該循環中,每個樣本的熒光增加超過背景。在擴增曲線的這一區域內,一個周期的差異相當于擴增PCR產物的兩倍。根據比較CT法,從每個樣本的每個基因CT值中減去每個樣本的GAPDH CT值,即可確定?CT值。計算??CT值時使用最高樣本?CT值(即目標表達量最低的樣本)作為任意常數,從所有其他?CT樣本值中減去。目標基因相對表達量的折疊變化用公式2-??CT確定。使用Prism5軟件包分析mRNA表達數據。
間歇性缺氧對男性生育能力的影響。第三組實驗旨在確定長期間歇缺氧對中年雄性小鼠生育能力的實際影響。對一組18只老齡小鼠(年齡:12個月)進行了為期60天的間歇性缺氧(對照組為常氧)。這些動物被隨機分為兩組(常氧組和間歇缺氧組分別為8只和10只),并分別稱重(35.0±2.2g和36.8±2.3g)。在間歇性缺氧或常氧條件下暴露2個月后,所有小鼠都進行了體內生育力測試。每只雄性小鼠連續5天與3只8-12w大的CD1雌性小鼠配對。在同居期間,每天都要檢查雌性小鼠的陰道塞子,作為交配的證據。交配試驗結束后,雄性動物通過宮頸脫位安樂死,并切除附睪和睪丸,以評估睪丸氧化應激和精子活力,如前所述。在妊娠第14天,使用二氧化碳對雌鼠實施安樂死,并記錄懷孕雌鼠的百分比、每窩再產率和窩產仔數等變量。活胎在檢查后安樂死。
結果
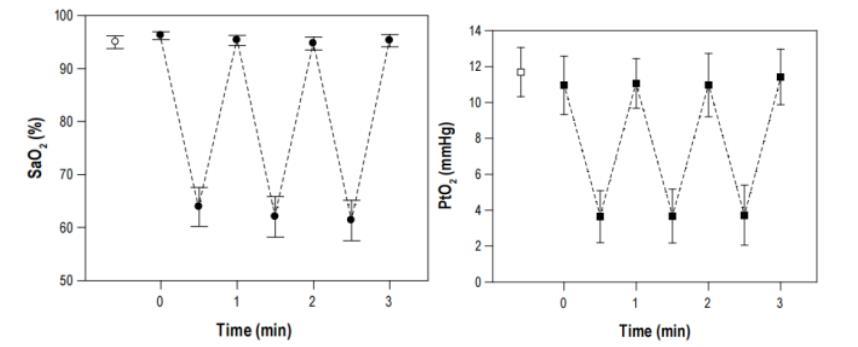
圖1、動脈血氧飽和度(SaO2)(左圖)和睪丸氧分壓(PtO2)(右圖)。基線SaO2值(94.9±1.9%)由圓圈表示,與最大值(95.4±0.1%)相似,與最小值62.3±3.5%相比有顯著差異(P<0.001)。睪丸PtO2從11.1±1.6mmHg(與基線值11.7±1.4相似,以方框表示)波動至3.6±1.5mmHg(P<0.001)。
由于間歇性呼吸低氧空氣,小鼠的SaO2經歷了從最大值95.4±0.1%(與基線值相似)到最小值62.3±3.5%(P<0.001)的周期性變化,從而模擬了在嚴重OSA患者身上觀察到的變化(圖1左)。對睪丸局部氧飽和度的測量表明,睪丸組織的氧分壓波動范圍相當大,從11.1±1.6mmHg(與基線值相似)降至3.6±1.5mmHg(P<0.001)(圖1右),這表明睪丸實際上處于缺氧-復氧的快速循環中。
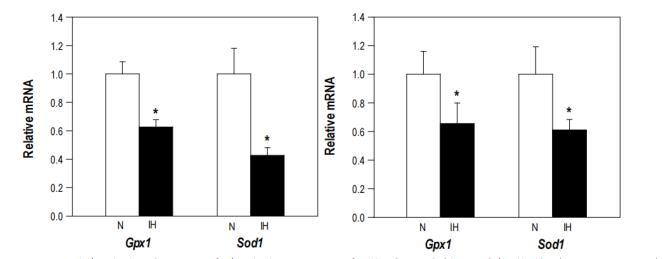
圖2、幼年小鼠(左圖)和中年小鼠(右圖)抗氧化酶谷胱甘肽過氧化物酶1(Gpx1)和超氧化物歧化酶1(Sod1)的相對基因表達。接受30天間歇性缺氧的年輕小鼠的Gpx1和Sod1表達量分別減少了37%和57%(P<0.05)。在接受60天間歇性缺氧的中年小鼠中,Gpx1和Sod1的表達分別減少了39%和34%(P<0.05)。IH,間歇性缺氧;N,常氧;mRNA,信使RNA。
間歇性缺氧30天后,在幼鼠睪丸水平檢測到氧化應激增加,因為與對照組相比,兩種主要抗氧化酶(Gpx1和Sod1)的表達量分別顯著降低了37%和57%(P<0.05)(圖2左)。過氧化氫酶的表達沒有明顯差異。在呼吸缺氧空氣60天的中年小鼠中,氧化應激的標記物也有類似的表現,Gpx1和Sod1的表達分別減少了39%和34%(P<0.05)(圖2右)。
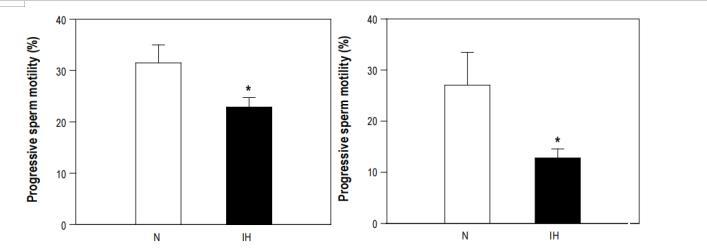
圖3、幼年小鼠(左圖)和中年小鼠(右圖)的精子活力(%)。間歇性缺氧后,年輕小鼠的精子活力從常氧組的31.5±3.5%降至30天間歇性缺氧組的22.9±1.8%(P<0.04)。中年小鼠的精子活力從對照組的27.0±6.4%下降到60天間歇缺氧組的12.8±1.8%(P=0.04)。N:常氧;IH:間歇性缺氧。
間歇缺氧30天后,年輕雄性的精子運動能力明顯降低(P<0.04):從常氧組的31.5±3.5%降至22.9±1.8%(圖3左)。其他精子參數(精子總濃度、存活率和凋亡;數據未顯示)無明顯差異。與常氧對照組相比,間歇缺氧60天的中年小鼠的精子運動能力下降幅度更大:從常氧組的27.0±6.4%降至12.8±1.8%(P=0.045)(圖3右)。
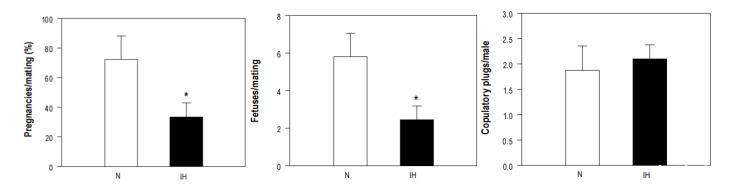
圖4、交配試驗后每次交配的懷孕雌性(%)(左圖)、每次交配的平均胎兒數(中圖)和每只雄性的交配次數(右圖)。與間歇缺氧組(0.33±0.10)相比,對照組(0.72±0.16)每次交配的懷孕雌性數量更高(P=0.04)。與對照組(5.80±1.24)相比,間歇性缺氧組每次交配的胎兒數減少(2.45±0.73)(P=0.025)。每只雌魚的交配栓數量沒有差異:常氧組為0.62±0.16,間歇缺氧組為0.70±0.09。N,常氧;IH,間歇性缺氧。
間歇性缺氧導致雄性實際生育力明顯下降。常氧組(0.72±0.16)每次交配的懷孕雌性數量(P=0.04)明顯高于間歇性缺氧組(0.33±0.10)(圖4左)。此外,與常氧對照組(5.80±1.24)相比,間歇缺氧組每次交配的胎兒數(2.45±0.73)減少了(P=0.02)(圖4中)。同樣,兩組的每胎平均胎兒數相似(對照組為8.10±0.19,間歇性缺氧組為7.42±0.65),表明能使雌性受孕的雄性精子質量足以產生正常的胎兒數。間歇缺氧組與對照組的每胎再孕次數沒有差異。如圖4右圖所示,觀察到的雄性繁殖力下降(包括懷孕雌性和胎兒數量)并不是由于交配次數減少造成的,因為常氧組和間歇性缺氧組每只雌性的交配次數相似:分別為0.62±0.16和0.70±0.09。
 相關新聞
相關新聞