熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
腫瘤組織氧分壓狀況
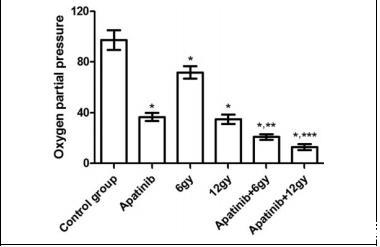
圖3腫瘤組織氧分壓。小鼠安樂死后測定氧分壓。*P<0.05與對照組相比。**P<0.05與阿帕替尼組(6 Gy)相比。與阿帕替尼組(12 Gy)相比,***P<0.05。
在采用不同的治療方案并完成PET/CT檢查后,測定腫瘤組織的分氧壓。圖3顯示了各治療組的腫瘤組織分氧壓結果。對照組的腫瘤分氧壓明顯高于其他組(P<0.05)。此外,與6 Gy治療組相比,12 Gy治療組小鼠的腫瘤組織分氧壓較低(P<0.05)。與單獨使用阿帕替尼或放療的小鼠相比,聯合組的腫瘤分氧壓更低(P<0.05)。
使用針對p-VEGFR-2和CD31的抗體進行免疫組織化學分析
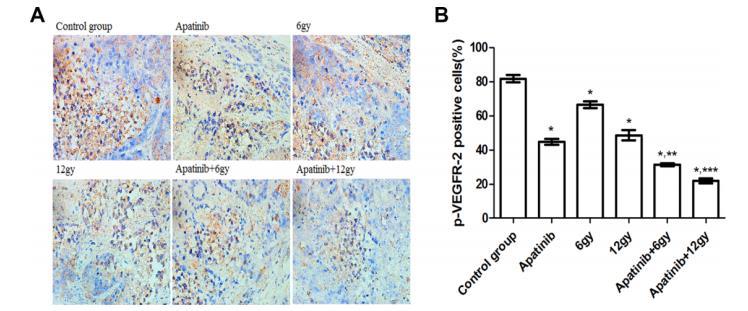
圖4 VEGFR-2磷酸化(p-VEGFR-2)在CNE-2鼻咽癌(NPC)腫瘤組織中的表達。A、使用p-VEGFR-2抗體對接受不同治療方案的異種移植CNE-2鼻咽癌小鼠進行免疫組化染色。B、治療組內p-VEGFR-2陽性率(%)。與對照組相比,*P<0.05。**P<0.05與阿帕替尼組相比,6 Gy。與阿帕替尼組(12 Gy)相比,***P<0.05。
使用針對p-VEGFR-2的抗體對異種移植物進行免疫組化染色顯示了不同治療方案的效果,并表明各治療組中p-VEGFR-2陽性細胞的比例不同(圖4)。對照組的陽性細胞比例最高(P<0.05)。與6 Gy治療組相比,12 Gy治療組小鼠的p-VEGFR-2陽性細胞比例較低(P<0.05)。此外,與單獨使用阿帕替尼或放療的小鼠相比,聯合治療組小鼠的p-VEGFR-2陽性細胞比例較低(P<0.05)。
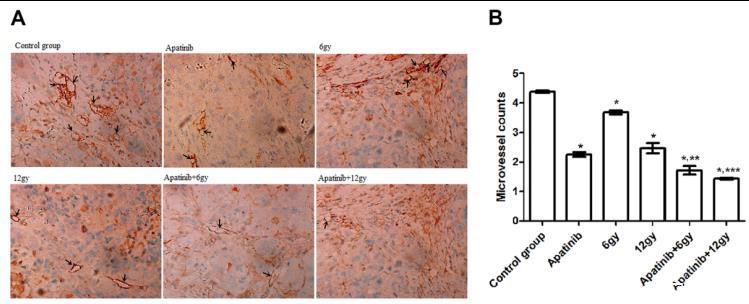
圖5 CNE-2鼻咽癌(NPC)腫瘤組織中CD31的表達。A、使用CD31抗體對接受不同治療方案的異種移植小鼠進行免疫組化染色,顯示微血管密度的差異。B、顯示各組血管數量的直方圖。*P<0.05與對照組相比。**P<0.05與阿帕替尼組(6 Gy)相比。與阿帕替尼組(12 Gy)相比,***P<0.05。
CD31陽性細胞呈棕色,在腫瘤組織中呈異質性分布(圖5),用于測定MVD,作為血管生成的標志物。對照組小鼠的MVD高于其他組小鼠(P<0.05)。經12 Gy處理的小鼠的MVD比經6 Gy處理的小鼠低(P<0.05)。此外,與單獨使用阿帕替尼或放療的小鼠相比,阿帕替尼+放療聯合治療組小鼠的MVD更低(P<0.05)。
討論
阿帕替尼是一種小分子VEGFR-2酪氨酸激酶抑制劑,可抑制腫瘤血管生成,從而達到抗腫瘤效果。許多研究表明,鼻咽癌患者體內存在VEGF/VEGFR過度表達。Peng等人的研究表明,阿帕替尼通過抑制VEGFR-2對CNE-2型鼻咽癌有抗腫瘤作用,并與順鉑有協同作用。在本研究中,我們在小鼠異種移植模型中探討了阿帕替尼聯合放療治療鼻咽癌的效果。
我們的研究表明,阿帕替尼具有抗腫瘤作用。隨著放射劑量的逐漸增加,單獨接受放射治療的小鼠的腫瘤生長速度逐漸加快。在阿帕替尼和放療聯合治療的小鼠中,腫瘤生長受到明顯抑制,與單獨使用阿帕替尼或放療的效果相比,抑制效果更高。聯合效應Q表明,阿帕替尼與放療聯合治療鼻咽癌具有協同作用。
VEGF/VEGFR-2信號通路是參與血管生成的主要通路。阿帕替尼通過抑制p-VEGFR-2抑制血管生成,減少腫瘤組織的營養和氧氣供應。與單獨治療組小鼠相比,聯合治療組小鼠在抑制腫瘤中p-VEGFR-2的表達、抑制血管生成、減少腫瘤組織的營養和供氧方面表現更好。我們假設阿帕替尼可以短暫改善腫瘤的缺氧狀態,但由于血管生成受到強烈抑制,氧氣供應減少,測量的氧分壓也隨之下降。與阿帕替尼單獨治療的效果相比,聯合治療的抗血管生成效果更強,從而導致腫瘤內的氧分壓降低。針對血管內皮生長因子受體-2的抗體(DC101)與放療聯合使用可抑制腫瘤血管生成,從而顯示出協同抗腫瘤效應。與接受單一療法的小鼠相比,接受聯合療法的小鼠缺氧程度明顯更高。西地尼布(AZD2171)聯合放療會增加腫瘤組織的缺氧程度。這些發現與我們的研究結果一致。我們發現,與阿帕替尼+6 Gy治療小鼠(Q=1.079)相比,阿帕替尼+12 Gy治療小鼠(Q=1.156)的抗腫瘤效果更好。此外,研究結果表明,阿帕替尼與放療協同抑制鼻咽癌治療的主要機制可能涉及抑制血管生成。
腫瘤細胞的新陳代謝十分旺盛。作為目前應用最廣泛的代謝成像劑,18F-FDG可以定量分析腫瘤的糖代謝。PET-CT檢查被廣泛應用于腫瘤代謝的評估。氟脫氧葡萄糖(FDG)攝取較差的腫瘤往往對治療反應較好,而快速攝取FDG的腫瘤往往對治療反應較差,預后較差。腫瘤的最大SUV與對側脊柱旁肌肉的最大SUV之比代表T/M值。腫瘤組織中FDG攝取越高,T/M值越高,反之亦然。Groves等人的研究表明,18F-FDG攝取量與早期乳腺癌的血管生成高度相關,18F-FDGPET可能在原發性乳腺癌患者的治療中發揮作用,即使是早期乳腺癌。Kaira等人的研究表明,轉移性肺腫瘤的18F-FDG攝取量取決于是否存在葡萄糖代謝(Glut1)、葡萄糖磷酸化(己糖激酶I)、缺氧(HIF-1a)和血管生成(VEGF和MVD)。Guo等人的研究表明,血管生成與肺腺癌的18F-FDG攝取呈正相關。Kaira等人的研究表明,用18FFMT和18F-FDG進行正電子發射計算機斷層顯像研究評估的原發性腫瘤的代謝活動與非小細胞肺癌的腫瘤血管生成和增殖活動有關。研究還表明,18F-FDG動力學受血管生成相關基因的調節。上述研究發現,腫瘤FDG攝取與血管生成呈正相關。在本研究中,我們假設治療組的FDG攝取減少也可能與血管生成減少有關,而聯合治療組通過抑制血管生成減少腫瘤代謝,從而達到協同抗腫瘤的效果。
總之,阿帕替尼對鼻咽癌有抗腫瘤作用,而且阿帕替尼聯合放療對鼻咽癌有協同作用。與阿帕替尼+6 Gy治療小鼠相比,阿帕替尼+12 Gy治療小鼠的抗腫瘤效果更好。根據上述數據,提出以下假設:(1)阿帕替尼通過抑制p-VEGFR-2、降低MVD、降低組織氧分壓來抑制腫瘤血管生成,從而達到抗腫瘤效果;(2)阿帕替尼聯合放療可增強抗血管生成,從而增強抗腫瘤效果;(3)阿帕替尼與放療協同抗腫瘤效果的主要機制包括增強抗血管生成。
 相關新聞
相關新聞