熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
結果
急性糖酵解抑制引起的神經元參數變化
圖1抑制海馬體切片糖酵解時的代謝和電參數。A:a)在CA1區,2-DG(7mM 15mM葡萄糖,抑制糖酵解約35%)降低了刺激Schaffer支脈誘發的eLFPs(施加2-DG后40分鐘)。然而,在一個切片中,eLFPs沒有減少,并顯示出多個次級尖峰(見插圖),表明網絡興奮性過高;b)2-DG減少了CA1(n=6,P<0.001)和齒狀回(n=4,P<0.03);=(c)2-DG引起靜息膜電位(Em;n=8,P<0.01)和GABA介導的電流反轉電位(EGABA;n=6,P<0.05)的去極化。B:2-DG還降低了CA1(n=6,P<0.001)和齒狀回(n=4,P<0.03)對突觸刺激(10Hz,10秒)反應的(a)(b)NAD(P)H瞬態和(c)驟降/過沖比顯著增加,與糖酵解受抑制一致。C:2-DG能明顯降低突觸刺激時的耗氧量。D:a)0.1mM 2,4-二硝基酚(DNP)抑制線粒體呼吸誘導靜息膜電位(Em;n=9,P<0.01)和EGABA(n=8,P<0.001),通過單個NMDA和GABA受體通道的細胞附著貼片記錄測量L2/3錐體細胞;b)將ACSF葡萄糖濃度降至0.2mM(n=6,Em和EGABA分別為P<0.05和0.01)也可獲得類似的效果。兩種情況下細胞內ATP濃度的降低程度相似。
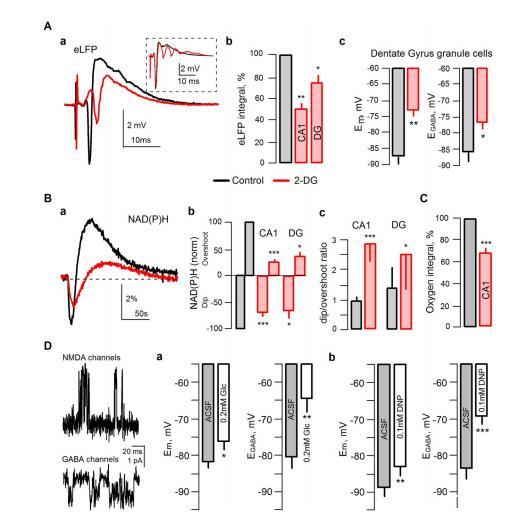
在海馬切片中,施用7mM 2-DG會誘發CA1和齒狀回層的局部場電位(eLFPs)(圖1Aa)逐漸降低(分別降低了49%±5%,n=6,P<0.01和25%±6%,n=4,P<0.03;圖1Ab)。
然而,在一個CA1切片中,eLFPs沒有減少,反而在2-DG作用下表現出多個次級群體尖峰,這表明網絡亢奮(見圖1Aa插圖)。此外,重復性突觸刺激(10赫茲,10秒)顯示了2-DG對網絡反應的不規則影響,eLFP總積分在對照組的114%和42%之間變化(平均值為76±12,n=6,P=0.099)。同時,在齒狀回顆粒細胞中,使用桔皮素穿孔貼片技術測量2-DG應用1小時后,2-DG誘導了Em(從-87.6±2.3到-73.3±1.5mV,n=8,P<0.01)和EGABA(從-85.8±3.1到-76.6±2mV,n=6,P<0.05)的顯著去極化。這些效應并非2-DG所特有,可以通過其他抑制能量代謝的方法再現,如將ACSF葡萄糖濃度降至0.2mM或使用氧化磷酸化抑制劑二硝基苯酚(0.1mM)(圖1D,單通道記錄)。
在CA1和齒狀回中,2-DG改變了NAD(P)H在重復性突觸刺激(10赫茲,10秒,圖1Ba、b)下的自發熒光瞬態:"浸潤"(氧化)和"過沖"(還原)兩種瞬態成分的振幅都減小了,而NAD(P)H的浸潤/過沖比值顯著增加(圖1Bc;CA1和DG信號分別為n=6,P<0.001和n=4,P<0.03),這證實糖酵解受到了抑制。2-DG也顯著降低了刺激誘導的CA1耗氧量(圖1C)。NAD(P)H熒光和耗氧量的減少可能并不是因為網絡對刺激的反應受到抑制,因為所有實驗中都觀察到了這兩個參數的減少,甚至那些應用2-DG后整體反應(訓練eLFP積分)增加的實驗也是如此。
因此,在切片中對糖酵解的急性抑制可使神經元去極化并降低GABA能抑制,從而提高突觸后興奮性,但同時也可能降低興奮性突觸傳遞的功效。據推測,2-DG對神經網絡興奮性的這些相反作用可以調和在體內報告的2-DG促沖動和抗驚厥急性效應。
慢性糖酵解抑制引發體內癲癇發生
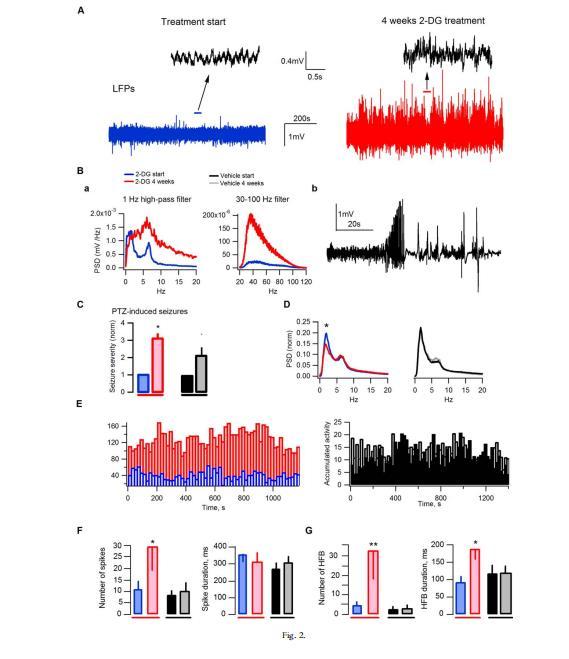
圖2長期抑制腦糖酵解會誘發大鼠癲癇。在自由活動的大鼠中,每天靜脈注射2-DG會導致陣發性活動的發生。A:一只大鼠在2-DG處理前(藍色跡線)和處理后(紅色跡線)的代表性LFP記錄;插圖(箭頭)清楚地顯示了靜止期振蕩活動的差異。B:a)A中所示LFP記錄的功率譜密度(PSD);b)在記錄過程中導致一只大鼠死亡的強直陣攣發作的例子。
為了研究2-DG在體內的長期影響,我們記錄了自由活動的大鼠在通過每天靜脈注射2-DG直接抑制腦糖酵解(10只大鼠接受2-DG治療,8只大鼠接受空白對照治療)前后的腦部活動。在2-DG治療4周后,我們在2只大鼠中檢測到了密集的自發性癲癇發作活動(平均次數分別為42.3次/小時和26.6次/小時,平均持續時間分別為57.9秒和38.6秒),而在其他2-DG治療大鼠或空白對照大鼠中均未檢測到癲癇發作活動。圖2A顯示了這兩只大鼠中的一只在2-DG治療4周前后記錄到的代表性LFP。插圖顯示了短時間的"靜止"基線活動,在治療前(左圖)存在明顯的θ節律振蕩,而在2-DG治療后(右圖)這種活動被完全破壞。事實上,服用2-DG后,低頻(以及主導頻率的轉換)和高頻的信號功率都顯著增加(圖2Ba)。
圖2 C:注射35毫克/千克PTZ后測量2-DG/空白處理前(藍色/黑色跡線)和處理后(紅色/灰色跡線)的平均癲癇嚴重程度。D:各組大鼠在治療前后的平均功率譜密度(均歸一化為總PSD積分)(2-DG組10只,空白載體組5只)。在Δ頻率范圍(1-4Hz),PSD峰值在2-DG作用下明顯變小。E:2-DG治療強烈增加了各組所有大鼠的平均累積活動。F:2-DG治療增加了LFP高振幅尖峰(尖波,在50至990毫秒時間范圍內測量)和(G)高頻爆發(HFBs;在100至250赫茲范圍內測量;詳見方法)的數量。
經2-DG處理的無自發性癲癇發作的大鼠(n=8)也表現出神經元網絡活動異常。如圖2D所示,經歸一化處理的平均PSD(所有大鼠;每只大鼠的PSD均歸一化為總PSD積分)顯示,經2-DG處理的大鼠在Δ范圍頻率(1-4Hz)的功率顯著降低。此外,這些動物還表現出一種過度活躍的網絡狀態,表現為"超基底"活動的顯著增加,即振幅超過基底水平的信號。此類事件可能由不同類型的生理或病理活動觸發,其累積水平可作為網絡興奮性的衡量標準。我們計算了所有LFP記錄中連續20秒的累積活動(見方法),并對各組大鼠的累積活動進行了平均(圖2E),結果發現2-DG處理后LFP累積活動顯著增加,表明誘發的陣發性活動水平很高。處理還導致高振幅尖峰的數量顯著增加(從每10分鐘記錄10.9±4.0到29.2±12.8,n=10;P<0.02;圖2F)。此外,2-DG還能誘導產生在60至250Hz頻率范圍內檢測到的多個高頻尖峰(從每10分鐘記錄4.2±1.9到32±14.5,n=10;P<0.01;圖2G;參見"方法"中的"LFP分析")。癲癇患者和動物癲癇模型的腦電圖中都曾出現過HFBs,它們被認為反映了與癲癇發生相應的病理活動。PTZ癲癇發作試驗(評估神經組織興奮性的變化)顯示,2-DG處理的大鼠癲癇發作閾值降低(圖2C)。共有三只經2-DG處理的大鼠死亡,其中一只是因為在記錄過程中強直-陣攣發作(圖2Bb),另外兩只是在夜間死亡(可能也是由于癲癇發作)。這些事件以及記錄的參數和分析有力地證明,2-DG確實會誘發網絡過度興奮,導致自發性癲癇發作。
總之,這些結果清楚地表明,長期抑制糖酵解會導致類似癲癇發生的神經網絡異常狀態。
 相關新聞
相關新聞