熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
動物模型和體內血管生成試驗:
股動脈結扎(FAL)和體內血管生成試驗按照之前的研究進行。簡而言之,用氯胺酮和甲苯噻嗪麻醉小鼠,并切除它們的后肢。體溫保持在37.0±0.5°C。通過一個2毫米的切口暴露左股動脈,切口不牽拉,盡量減少對組織的干擾。在股外側尾動脈和上淺動脈起源的遠端以及股動脈的近端(腹股溝韌帶下方)放置一個7-0結扎。在縫線之間橫斷股動脈并分離1-2毫米,用生理鹽水清洗傷口并密封。最后,注射丁丙諾啡(0.05-0.1毫克/千克)。
為了評估培養(yǎng)的EPCs的血管生成能力,將不同組(包括GPR4上調組和GPR4基線組)的EPCs(5×105個細胞)重懸于100-200μl的預熱PBS(37°C)中,然后移植到結扎動脈附近的5個部位。安慰劑小鼠也注射相同體積的PBS。使用激光多普勒成像儀檢測后肢皮下血流。分別在注射后0、3、7、14和21天測量缺血和非缺血后肢的血流量。21天后,小鼠被處死。肢體缺損評分按以下等級計算:0=無,1=趾尖壞死,2=趾部壞死,3=足部壞死,4=腿部壞死,5=整條腿缺失。
免疫組化和免疫熒光分析:
免疫組化染色如前所述。簡言之,進行右股動脈結扎和股淺動脈(SFA)切除。在0.01M檸檬酸鈉緩沖液(pH6.0)中通過微波爐加熱進行復水和抗原回收。按照制造商的說明,用兔單克隆PECAM-1抗體孵育切片,然后用HRP抗兔DAB檢測試劑盒檢測。使用光學顯微鏡獲取免疫組織學圖像。血管密度通過計數(shù)CD31切片免疫組化染色中的血管數(shù)量確定,并以每平方毫米血管數(shù)表示。
為了進行免疫熒光分析,所有切片都用一抗在4°C孵育過夜,然后用GFP結合物山羊抗兔二抗染色。為了評估不同組的細胞增殖情況,手術后2周內每天兩次皮下注射,組織切片也用Cy5結合的抗BrdU抗體(Sigma)染色,以評估毛細血管密度。細胞核用DAPI反染。使用共聚焦顯微鏡獲取免疫熒光圖像。
Real-timePCR檢測:
用高純度RNA分離試劑盒提取總RNA。使用PrimeScript®RT試劑盒合成第一鏈cDNA。使用StepOnePlus實時PCR系統(tǒng),采用2-ΔΔCT分析方法對該家族的mRNA表達進行量化,一式三份。GPR4的PCR引物如下:正向5′-AACCTCTATCGGGTGTTCGTG-3′,反向5′-TTGGCTGTGCTGTTCCTCTTGG-3′。擴增GAPDH作為內標。用2(-DeltaDeltaC(T))法測定每個樣本中的相對RNA水平。
液滴數(shù)字PCR檢測:
液滴數(shù)字PCR(ddPCR)和基于EvaGreenChemistry的數(shù)據(jù)分析按照生產(chǎn)商的說明進行。Supermix(2X)購自美國Bio-Rad。PCR中引物的最終濃度為200nM,最終反應體積為20μL。每個反應有1μLcDNA,NTC時加入1μL無核酸水代替cDNA。使用BioRad自動液滴發(fā)生器生成液滴。PCR條件如下95℃5分鐘,50℃30秒,56.5℃30秒,72℃45秒。最后在72℃延伸5分鐘,然后在4℃5分鐘和90℃5分鐘進行信號穩(wěn)定步驟。PCR結束后,使用QX200液滴閱讀器分析液滴,并使用Bio-RadQuantaSoft軟件分析數(shù)據(jù)。
Western印跡分析:
細胞在添加了1-mMPMSF的RIPA緩沖液中裂解。蛋白提取物經(jīng)SDS-PAGE處理后轉移到聚偏氟乙烯膜上。使用以下抗體:兔抗GPR4抗體、抗VEGFA抗體和兔抗GAPDH抗體。蛋白用HRP結合的抗兔IgG顯色,然后使用ECL化學發(fā)光系統(tǒng)顯色。
統(tǒng)計分析:
所有結果均表示為標準差±均值,通過學生t檢驗或方差分析評估統(tǒng)計學顯著性。P<0.05被認為具有統(tǒng)計學意義。所有統(tǒng)計分析均使用SPSS統(tǒng)計軟件(SPSS版本21.0)進行。
結果:
1.表型特征
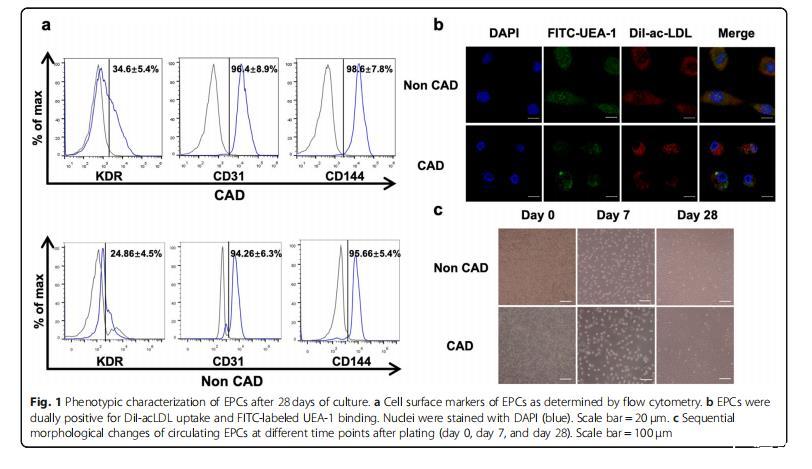
圖1:培養(yǎng)28天后EPC的表型特征。a通過流式細胞術確定EPC的細胞表面標記。B EPC對DiI-acLDL攝取和FITC標記的UEA-1結合均呈陽性。細胞核用DAPI(藍色)染色。c循環(huán)EPCs在培養(yǎng)后不同時間點(第0天、第7天和第28天)的形態(tài)變化序列。
共有20人參加了研究,其中CAD組和健康組各有10人。兩組基線特征無明顯差異。晚期EPC由培養(yǎng)28天的PBMNCs獲得(圖1c),與之前的研究類似。培養(yǎng)28天后,通過流式細胞術分析培養(yǎng)的EPCs的標記蛋白,包括KDR、CD31和CD144(圖1a),EPCs的DiI-acLDL攝取和FITC標記的凝集素-1結合均為陽性(圖1b)。
2.不同的EPC在酸性環(huán)境中具有不同的血管生成能力
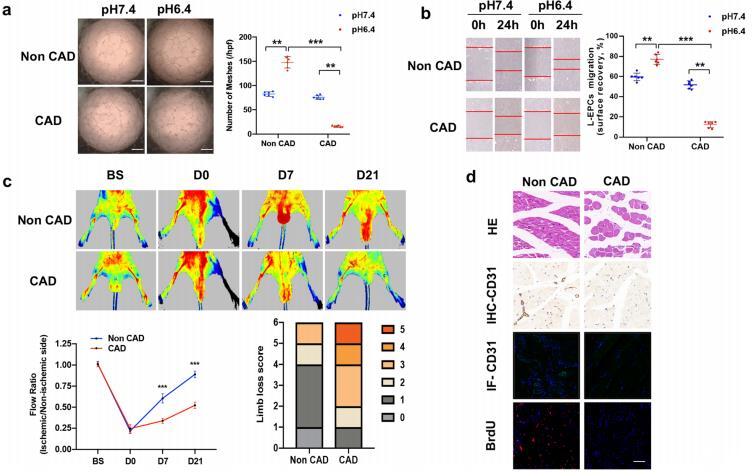
圖2:不同pH環(huán)境對來自非CAD和CAD患者的EPC血管生成的影響。a,b不同pH環(huán)境培養(yǎng)6h后,EPC管形成(a比例尺=40μm)和遷移(b比例尺=20μm)的代表性照片和定量分析。c來自非CAD或CAD后肢缺血的EPC介導的新生血管的代表性照片和定量分析。D HE、IHC-CD31、IF-CD31和BrdU染色的后肢缺血切片,以及CD31陽性血管、CD31陽性微血管和BrdU陽性細胞的定量分析。
為了確定不同患者EPC的體外血管生成能力,采用了Matrigel實驗。與在pH值為7.4的環(huán)境中相比,非CAD組的EPCs在酸刺激下的血管生成明顯增強,而CAD組的EPCs在相同處理下的結果則相反(圖2a)。傷口愈合的結果也類似(圖2b)。為了進一步探討這些結果的穩(wěn)健性,我們將非CAD組和CAD組的EPCs全身注射到后肢缺血的裸鼠體內,結果顯示,與注射CAD組EPCs的裸鼠相比,注射非CAD組EPCs的裸鼠血流恢復更快(圖2c)。后肢的免疫組化結果見圖2d。
3.EPC上質子傳感G蛋白偶聯(lián)受體的表達
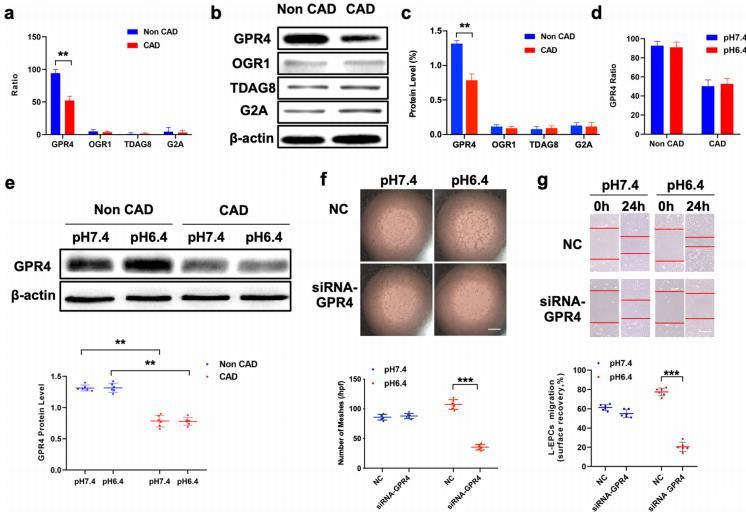
圖3:非CAD和CAD患者EPCs中質子傳感GPCR家族的表達和血管生成能力。a使用dPCR測定EPCs中質子感應GPCR家族表達的mRNA水平。b,c GPCR家族蛋白質水平的代表性照片和定量分析。d dPCR用于測定不同pH環(huán)境中GPR4的mRNA水平。e不同pH值環(huán)境下GPR4表達的定量分析和代表性照片,然后用GPR4抗體進行免疫印跡。f,g用siRNA-NC或siRNA-GPR4轉染EPCs,拍攝Matrigel管樣形成試驗(比例尺=40μm)和劃痕試驗(比例尺=20μm)的代表性照片并進行定量分析。
與使用ddPCR對其他類型細胞進行的研究類似,我們的結果顯示,四種類型的質子傳感G蛋白偶聯(lián)受體亞型均在EPCs上表達,其中GPR4的表達量最高,這一點在Western印跡中得到了進一步證實(圖3a-c)。此外,ddPCR和Western印跡結果顯示,在酸性環(huán)境中,CAD患者的GRP4表達量明顯低于非CAD患者,而無論pH值如何,組間差異均未達到統(tǒng)計學意義(圖3d,e)。在使用siRNA-GRP4下調GRP4表達的CAD患者的EPCs中,我們發(fā)現(xiàn)EPCs的體外血管生成能力在酸性環(huán)境中受損,而在pH7.4環(huán)境中沒有受損(圖3f),傷口愈合試驗也得出了類似的結果(圖3g)。
4.GPR4基因轉移增強了酸性微環(huán)境中EPC的血管生成能力
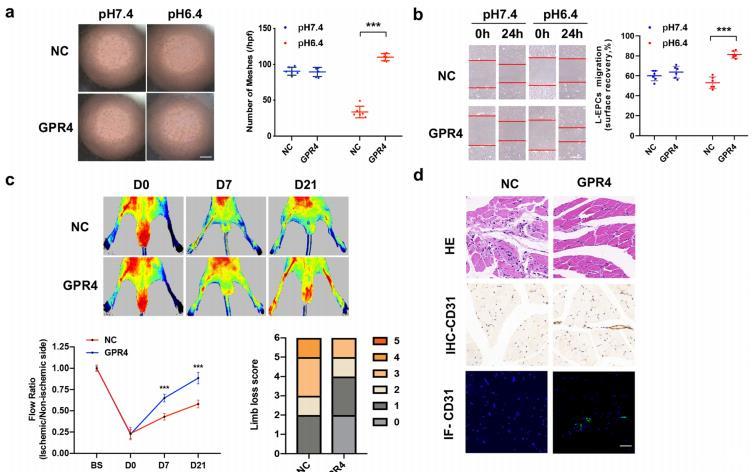
圖4:GPR4基因轉移可恢復CAD患者EPCs酸性介導的血管生成。a,b EPCs在不同pH環(huán)境中培養(yǎng)6h后,管形成(a比例尺=40μm)和遷移(b比例尺=20μm)的代表性照片和定量分析。c注射EPCs后裸鼠后肢缺血血流的代表性照片和定量分析。d缺血后肢的HE、IHC-CD31和IF-CD31染色切片。
將人類GPR4cDNA克隆到真核表達質粒中。Western印跡證實了GPR4在EPCs中的轉錄和表達。與載體轉導的EPCs相比,pcDNA3.1(+)-GPR4轉導的EPCs在酸性微環(huán)境中的血管生成明顯增強,而在pH值為7.4的環(huán)境中,組間差異未達到統(tǒng)計學意義(圖4a,b)。
為了確定GPR4基因轉移對EPC介導的體內血管生成的影響,將pcDNA3.1(+)-GPR4轉導的EPCs和載體轉導的EPCs全身注射到后肢缺血的裸鼠體內。值得注意的是,與載體轉導的EPCs相比,pcDNA3.1(+)-GPR4轉導的EPCs能明顯增加裸鼠后肢皮下血流量(圖4c)。后肢的免疫組化和免疫熒光見4d。
 相關新聞
相關新聞