熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
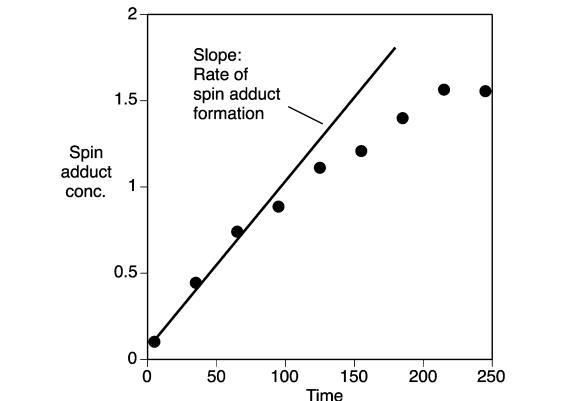
麥汁ESR強(qiáng)制老化測(cè)試:麥汁樣品(25.0毫升),含有5%(體積/體積)乙醇(96%純乙醇,丹麥蒸餾廠,奧爾堡,丹麥)和POBN[α-4-吡啶基-1-氧化物-N-叔丁基硝酮,Aldrich,St.Louis,MO],在密閉的藍(lán)蓋瓶(250毫升)中于室溫下攪拌10分鐘,以使反應(yīng)物溶解。瓶子內(nèi)有足夠的大氣空氣頂部空間。將瓶子轉(zhuǎn)移到預(yù)熱的水浴(T=55°C)(Heto Laboratory Equipment,Allerod,Denmark)中。在給定的時(shí)間間隔取出樣品(50μL)。使用Miniscope MS 200 X波段光譜儀(Magnettech,Berlin,Germany)記錄麥汁樣品的ESR光譜,使用50μL微量移液管作為樣品池(Brand GMBH,Wertheim,Germany)。使用的設(shè)置如下:微波功率,10 mW;掃描寬度,95.9 G;調(diào)制頻率,1000 mG;接收增益,900;掃描時(shí)間,60秒。所有光譜(單次掃描)均在室溫下記錄。光譜的振幅以中心雙峰的高度相對(duì)于TEMPO水溶液(2μM)ESR信號(hào)中心線的高度進(jìn)行測(cè)量和報(bào)告。TEMPO標(biāo)準(zhǔn)品在當(dāng)天第一個(gè)和最后一個(gè)樣品時(shí)進(jìn)行測(cè)量。所有樣品均進(jìn)行三次重復(fù)測(cè)量。麥汁樣品的氧化穩(wěn)定性通過(guò)自旋加合物形成的初始速率來(lái)量化,該速率由在強(qiáng)制老化期間自旋加合物濃度初始上升階段(在自旋加合物濃度開(kāi)始趨于平穩(wěn)之前)的線性回歸確定(圖3)。
加熱麥汁的耗氧量:將室溫麥汁樣品轉(zhuǎn)移到4毫升測(cè)量室(MR-Chamber,Unisense,Aarhus,Denmark)中,不留空氣頂部空間。將裝滿的測(cè)量室置于預(yù)熱的水浴(T=60°C)(Heto Laboratory Equipment,Allerod,Denmark)中。測(cè)量室配備克拉克電極(Unisense NR-sensor,Aarhus,Denmark),并立即開(kāi)始測(cè)量。通過(guò)氧分析儀(Picoammeter PA 2000,Unisense,Aarhus,Denmark)每10秒記錄一次氧濃度。測(cè)量前使用兩點(diǎn)校準(zhǔn)(60°C空氣飽和水和60°C的0.1 M抗壞血酸鈉在0.1 M NaOH溶液中)來(lái)校準(zhǔn)電極和氧分析儀。
添加鐵的醪液和麥汁的ESR強(qiáng)制老化測(cè)試:從新鮮制備的FeSO4(Merck,Darmstadt,Germany)水溶液儲(chǔ)備液中,將最終濃度為50μM的FeSO4添加:(i)在糖化開(kāi)始時(shí),即麥芽與水混合時(shí),添加到醪液中;或(ii)添加到糖化和過(guò)濾后獲得的麥汁中。對(duì)糖化25分鐘和125分鐘后收集的麥汁樣品進(jìn)行ESR強(qiáng)制老化測(cè)試。
金屬分析:使用原子吸收光譜法(Perkin-Elmer 3300,United States)測(cè)定在糖化開(kāi)始25分鐘和125分鐘后收集的麥汁樣品中的Fe和Cu濃度。比較了向麥汁樣品中添加50μM FeSO4:(i)在糖化開(kāi)始時(shí)添加;(ii)在糖化和過(guò)濾后添加到麥汁中;以及未添加FeSO4的對(duì)照麥汁。
過(guò)氧化氫、過(guò)氧化氫酶和超氧化物歧化酶的影響:將過(guò)氧化氫(30%,Sigma-Aldrich,Steinheim,Germany)、過(guò)氧化氫酶(E.C.1.11.1.6,來(lái)自Scytalidium thermophilum的純酶,無(wú)葡萄糖氧化酶副活性,Novozymes A/S,Bagsvaerd,Denmark)或牛超氧化物歧化酶(E.C.1.15.1.1)(Sigma-Aldrich,Steinheim,Germany)在添加乙醇和POBN之前立即添加到冷藏的麥汁樣品中,并按上述方法進(jìn)行ESR強(qiáng)制老化實(shí)驗(yàn)。一個(gè)過(guò)氧化氫酶單位(CIU)對(duì)應(yīng)于在pH 7和30°C下每分鐘分解1μmol過(guò)氧化氫的酶量。CIU通過(guò)分光光度法測(cè)定,評(píng)估在30°C、50 mM磷酸鹽緩沖液(pH 7.0)中,過(guò)氧化氫酶在240 nm處去除H2O2的情況[ε=39.4 M?1cm?1],將在240 nm處吸光度從0.450(H2O2起始濃度為10.3 mM)降至0.400所需的時(shí)間(秒)轉(zhuǎn)換為每克酶產(chǎn)品的CIU。一個(gè)超氧化物歧化酶單位(SODU)將在偶聯(lián)系統(tǒng)(含黃嘌呤和黃嘌呤氧化酶)中,在pH 7.8、25°C、3.0 mL反應(yīng)體積下,使用引起550 nm處吸光度變化率為0.025每分鐘的黃嘌呤氧化酶濃度,抑制細(xì)胞色素c還原速率的50%。
統(tǒng)計(jì)分析:使用SAS JMP 6.0.0軟件包(SAS Institute,Inc.,United States)進(jìn)行統(tǒng)計(jì)分析。通過(guò)方差分析確定主效應(yīng)的顯著性。使用最小顯著差異(LSD)檢驗(yàn)識(shí)別平均值之間的顯著(p<0.05)差異。
結(jié)果
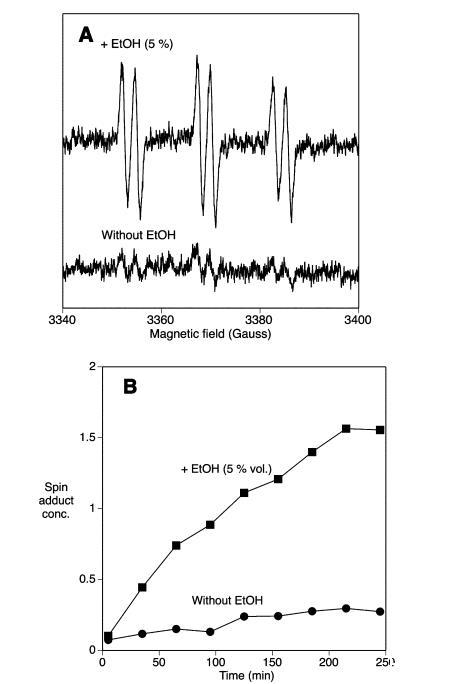
甜麥汁的氧化穩(wěn)定性:麥汁的氧化穩(wěn)定性通過(guò)一種基于ESR的方法進(jìn)行研究,該方法類似于評(píng)估啤酒風(fēng)味穩(wěn)定性的既定方法。將自旋捕獲劑添加到糖化不同階段收集的麥汁中,通過(guò)ESR檢測(cè)在有空氣接觸加熱過(guò)程中形成的自旋加合物。單獨(dú)使用自旋捕獲劑POBN得到ESR可檢測(cè)的信號(hào),這些信號(hào)隨時(shí)間增加但振幅非常低(圖2)。同時(shí)添加乙醇和自旋捕獲劑顯著增加了信號(hào)的振幅,正如Franz和Back先前所示。在乙醇存在下形成的POBN自旋加合物具有超精細(xì)耦合常數(shù)(aN=15.5 G和aH=2.5 G),與1-羥乙基自由基形成的自旋加合物的預(yù)期值相似。在無(wú)乙醇情況下形成的弱ESR信號(hào)具有非常相似的超精細(xì)耦合常數(shù)(aN=15.3 G和aH=2.6 G),這表明捕獲的是碳中心自由基。
在所有甜麥汁樣品中,自旋加合物的形成沒(méi)有初始滯后期,并且在樣品長(zhǎng)時(shí)間加熱過(guò)程中形成的自旋加合物量趨于平穩(wěn)。然而,不同麥汁樣品之間的形成速率和形成的自旋加合物水平存在差異。在氮?dú)鈿夥障录訜猁溨瓨悠穾缀跬耆璧K了自旋加合物的形成(數(shù)據(jù)未顯示)。這表明自旋加合物的形成與麥汁中的氧化反應(yīng)密切相關(guān)。自旋加合物的形成預(yù)計(jì)是導(dǎo)致自由基形成的促氧化效應(yīng)與淬滅自由基的抗氧化效應(yīng)之間競(jìng)爭(zhēng)的結(jié)果。因此,麥汁樣品的氧化穩(wěn)定性通過(guò)自旋加合物形成的初始速率來(lái)量化,該速率是在強(qiáng)制老化期間自旋加合物濃度初始上升階段,在自旋加合物濃度開(kāi)始趨于平穩(wěn)之前確定的(圖3)。在抗氧化防御能力低(阻礙氧化過(guò)程)和/或促氧化成分水平高(有利于自由基形成)的麥汁樣品中,預(yù)計(jì)自由基形成的初始速率較高。無(wú)論哪種情況,與產(chǎn)生低自旋加合物形成速率的樣品相比,該麥汁的氧化穩(wěn)定性預(yù)計(jì)會(huì)受損。
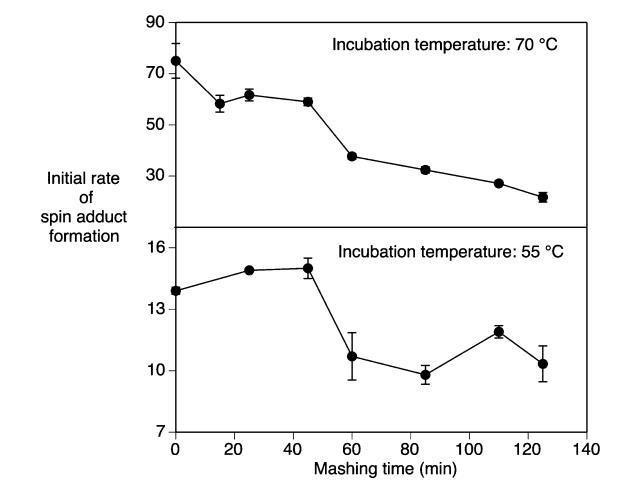
糖化過(guò)程中甜麥汁的氧化穩(wěn)定性:在糖化程序的不同階段收集麥汁樣品,并通過(guò)自旋捕獲方法評(píng)估其氧化穩(wěn)定性。通常,來(lái)自糖化初始低溫階段(投料)的麥汁樣品比后期高溫階段的樣品顯示出更高的自旋加合物形成速率(圖4)。當(dāng)糖化溫度升高時(shí),觀察到自旋加合物形成速率的明顯變化。這種變化也與收集的麥汁樣品中浸出物含量的變化相吻合(圖1)。因此,通過(guò)比較添加蔗糖增加溶解有機(jī)物含量后的麥汁樣品的自旋加合物形成速率,檢查了麥汁樣品中浸出物水平對(duì)自旋加合物形成速率的影響。當(dāng)糖化25分鐘后收集的麥汁密度(8.4°Brix)通過(guò)添加蔗糖加倍(17.8°Brix)達(dá)到與糖化后期麥汁相當(dāng)?shù)慕鑫锖繒r(shí),自旋加合物的形成速率僅下降了24%。將麥汁密度增加到32°Brix并未導(dǎo)致自旋加合物形成速率的進(jìn)一步降低(數(shù)據(jù)未顯示)。這表明蔗糖可能在一定程度上充當(dāng)自由基清除劑。因此,與后期階段相比,糖化早期階段觀察到的自由基形成增加不能完全用°Brix的差異來(lái)解釋。另一方面,在糖化過(guò)程中溫度升高期間,醪液中發(fā)生了許多其他化學(xué)變化,例如淀粉的糊化和糖化、蛋白質(zhì)的水解和變性、以及涉及脂質(zhì)、蛋白質(zhì)、多酚和碳水化合物的眾多氧化反應(yīng)。
 相關(guān)新聞
相關(guān)新聞
 相關(guān)問(wèn)題
相關(guān)問(wèn)題