熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
摘要
了解微環境或生態位如何調節干細胞活性,是理解干細胞生物學和制定干細胞治療策略的核心。低氧張力(缺氧)通常被認為是維持多種干細胞類型靜止的共同生態位特征。然而,支持缺氧龕存在的證據主要來自間接證據,如蛋白質組分析、HIF-1和相關基因的表達,以及替代性缺氧標記物(如咪唑)染色。在這里,我們對活體小鼠骨髓(BM)中的局部氧張力(pO2)進行了直接的活體測量。利用雙光子磷光壽命顯微鏡(2PLM),我們確定盡管血管密度非常高,但骨髓的絕對pO2卻相當低(<32mmHg)。我們進一步發現了局部pO2的異質性,在較深的竇周區域發現了最低的pO2(約9.9mmHg或1.3%)。相比之下,骨膜內區域的缺氧程度較低,因為該區域有小動脈灌注,而這些小動脈的標記物nestin通常呈陽性。這些pO2值在放療和化療后發生顯著變化,表明壓力在改變干細胞代謝微環境中的作用。
造血干細胞(HSC)龕位在BM內的確切位置仍然難以確定,有證據支持血管龕位和骨內膜龕位的存在。由于包括骨內膜區域在內的基底膜灌注密集,我們不禁要問,如此高血管化的組織如何能在低氧微環境中孕育造血干細胞?我們通過仿真模型發現,在遠離血管的短距離內,可能存在非常陡峭的pO2梯度,從而形成缺氧區。然而,目前還沒有關于直接測量BM內局部氧分布的報道。
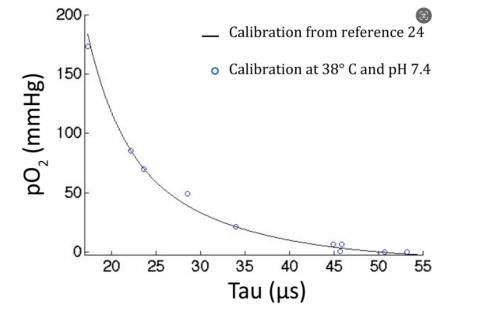
擴展數據圖2、PtP-C343溶液的PO2值與我們的顯微鏡記錄的磷光壽命測量值的函數關系圖。PO2由插入溶液中的氧氣微電極測定。實線是不同實驗室記錄的同一批PtP-C343的已公布校準曲線。
在這里,我們在專為活體動物成像設計的雙光子顯微鏡上實現了2PLM技術。這種全光學設計(擴展數據圖1)可通過完整的頭骨以微米級的空間分辨率在BM內的精確位置進行非接觸式pO2測量。成像前,系統注入基于金屬卟啉的雙光子增強磷光探針PtP-C343。鉑卟啉(PtP)的發射三重態對局部氧氣濃度高度敏感。與溶解氧的雙分子碰撞會縮短探針的三重態壽命并淬滅磷光。因此,通過測量激發脈沖后的磷光衰減時間τ,就可以根據預先建立的τvs.pO2校準曲線(擴展數據圖2)確定pO2的絕對值。PtP-C343中的金屬卟啉由樹枝狀聚合物和聚乙二醇(PEG)包覆層保護(擴展資料圖3),以確保生物相容性并防止探針與生物大分子發生不必要的相互作用。為了提高雙光子激發截面,在樹枝狀聚合物外殼上接枝了幾個香豆素-343(C343)分子,作為雙光子"天線",通過分子內能量轉移將捕獲的能量導向金屬卟啉。
探針中香豆素單位的殘余熒光使我們能夠通過傳統的雙光子激發熒光觀察到BM血管,同時通過膠原二次諧波發生(SHG)信號觀察到骨骼。我們證實,BM中的血管密度很高(圖1a-c),圖像堆棧中95%以上的體素距離最近的血管小于25μm(圖1b-c)。然后,我們使用2PLM對血管內多個位置的BM pO2進行了量化,得到的數值范圍為11.7到31.7mmHg(1.5-4.2%),平均值為20.4mmHg(2.7%)。這些值明顯低于大腦微血管、骨膜和皮質骨中的pO2值(圖1d)。在許多情況下,我們能夠跟蹤單個血管從骨骼穿入BM腔的過程(圖1e)。當沿著單個血管追蹤時,我們發現在進入BM腔前后測量到的pO2急劇下降(圖1e-f)。血液從低細胞度區域(皮質骨)流向高細胞度區域(BM),沿血流方向氧氣迅速耗盡,這讓人聯想到血管進入代謝需求高的實體瘤時觀察到的縱向pO2梯度。
由于BM血管的通透性相對較高,注入的探針(直徑約3-4納米)擴散出血管,并在幾分鐘內積累到足夠的濃度(擴展數據圖4),從而可以測量間質空間的pO2。根據數學模型,我們發現遠離血管的側向pO2梯度很陡,平均血管外pO2為13.3mmHg(1.8%),范圍在4.8到21.1mmHg(0.6-2.8%)之間(圖1d)。
我們在BM中測得的pO2值(血管內約20.4mmHg,血管外約13.3mmHg)與之前報道的使用氧電極測得的約18mmHg值非常吻合。不過,該測量方法缺乏空間分辨率,而且針電極的插入很可能損傷了微血管,因此只能記錄到血管內和血管外pO2的平均讀數。盡管如此,綜合來看,這些結果支持這樣一種觀點,即盡管血管密度很高,但整個BM是一個缺氧組織。
為了更精細地觀察BM內的氧分布,我們注意到血管是異質的,較小的血管更靠近骨膜內表面(圖2a)。直徑小于15μm的血管的2PLM顯示的pO2(22.7mmHg,3.0%)高于直徑大于15μm的血管(19.5mmHg,2.6%,p<0.03)。因此,當我們分析距骨膜不同距離的pO2值時,發現距骨>40μm區域的pO2值最低,血管內為17.7mmHg,占2.4%;血管外為9.9mmHg,占1.3%(圖2a)。在大多數較小血管所在的骨膜內區域(0-20μm區域),pO2讀數略高,血管內的數值為21.9mmHg(2.9%,p<0.03),血管外的數值為13.5mmHg(1.8%,p<0.01)(圖2a)。這些測量結果表明,隨著與骨膜距離的增加,pO2梯度適中,但梯度的方向出乎意料。我們發現,pO2并非隨著距離骨膜的增加而降低,而是隨著距離骨膜的增加而向更缺氧的竇狀區域移動,而不是骨膜內區域最缺氧。
由于目前還沒有造血干細胞特異性標記物可用于觀察平衡狀態下的內源性干細胞,我們使用了nestin-GFP小鼠來幫助確定造血干細胞所在的位置。nestin由參與造血干細胞維持和運輸的BM間充質干細胞(MSCs)亞群表達,血管周圍的nestin-GFP亮細胞定義了靜止造血干細胞龕位。我們推斷,如果缺氧調節靜止,那么nestin-GFP細胞就應該是BM缺氧區域的標志。在nestin-GFP小鼠中,我們證實nestin+細胞主要分布在血管周圍,移植的造血干細胞也靠近nestin+血管(擴展數據圖5)。nestin+血管與nestin-血管在解剖學上截然不同,它們更靠近骨表面(10.9μm vs. 25.5μm,p<0.02),直徑更小(9.5μm vs. 22.9μm,p<2×10-6)(圖2b)。與我們的預期相反,我們發現nestin+血管的pO2明顯高于nestin-血管(22.8mmHg vs. 17.6mmHg,p<0.0007)(圖2c-d)。
接下來,我們研究了移植的造血干細胞/祖細胞(HSPCs)是否歸巢于具有不同pO2水平的骨髓龕。移植前,受體動物接受放射或化療(35mg/kg的丁胺卡那霉素)進行細胞再生調理。值得注意的是,這兩種治療方法都導致了整個骨髓細胞pO2的大幅升高(圖3a)。考慮到放療和化療后血管都受到了嚴重破壞,pO2的升高令人震驚(擴展數據圖6a-c)。此外,雖然亞致死照射(4.5Gy)后血管內pO2值基本不變,但血管內和血管外pO2之間的梯度消失了,血管外pO2上升到與血管內pO2相同的水平(圖3a)。隨著與骨膜距離的增加,pO2下降的"負"梯度也消失了(圖3b)。在致命性照射和丁胺苯磺胺治療的病例中,廣泛的血管損傷導致染料大面積滲漏,以至于血管內和血管外空間的界限再也無法劃分。
 相關新聞
相關新聞