熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
研究意義:本項突破性研究揭示了乳酸在大腦中的雙重角色:正常狀態下,它是維持神經信號傳遞和記憶形成的“能量快遞員”;但在癲癇患者腦中,它卻成了維持病態放電的“幫兇”。科學家通過抑制乳酸轉運蛋白發現,健康腦組織會因能量短缺而降低神經活動效率,而癲癇腦組織中的異常放電頻率卻顯著下降。這一發現不僅解開了大腦能量代謝的關鍵謎題,更指向了治療耐藥性癲癇的新靶點——通過阻斷乳酸轉運,或可開發出副作用更小的抗癲癇療法。
核心機制解讀
乳酸的“天使與魔鬼”雙重身份
健康大腦中的乳酸
就像快遞員在細胞間穿梭,乳酸通過單羧酸轉運體(MCT)從星形膠質細胞輸送給神經元(圖1)。當研究人員用抑制劑4-CIN阻斷這條通路時,發現:
能量危機:神經突觸傳遞效率下降38%,恢復細胞內外離子平衡的速度延緩2倍
警報系統啟動:能量敏感型鉀通道(KATP)因ATP短缺而開啟,主動抑制神經興奮性
代謝代償:細胞啟動備用能量通路,線粒體復合體II活性異常升高
癲癇大腦的異常代謝
癲癇腦組織存在獨特的“乳酸陷阱”:
血管上的轉運體MCT1減少→乳酸無法排出腦組織
星形膠質細胞上的MCT4增多→更多乳酸堆積在細胞間隙
病理結果:乳酸濃度升高本應抑制神經活動(通過酸性環境),但實際卻持續喂養癲癇放電
關鍵轉折點發現
當用藥物阻斷乳酸轉運時:
健康腦組織:神經活動受抑制(驗證乳酸的正常供能作用)
癲癇腦組織:癲癇樣放電頻率直降66%,持續時間縮短50%
核心機制:能量短缺激活腺苷A1受體,天然抑制癲癇放電
Unisense微電極實驗操作流程
大腦缺氧信號的精準捕捉者
實驗設備核心
Clark式氧敏感微電極(Unisense,Denmark)
尖端直徑:10微米(約頭發絲的1/8)
檢測精度:可測量0.5 mmHg氧分壓變化
操作流程
電極校準(圖1)
將電極依次浸入0%、50%、95%氧飽和的人工腦脊液
建立電流信號與氧分壓的對應曲線
圖1:電極校準示意圖,"Clark式微電極在0%、50%、95%氧飽和溶液中的校準曲線,確保組織檢測前信號線性穩定"
腦片檢測
將大鼠海馬/人腦切片置于恒溫灌流槽
微電極垂直插入CA3椎體神經元層
電刺激神經通路時,實時記錄組織耗氧波動
關鍵發現(圖2)
"當阻斷乳酸轉運后,刺激引發的耗氧峰下降20%,基線氧分壓升高12.7%,證明神經元正減少'燃料'消耗"
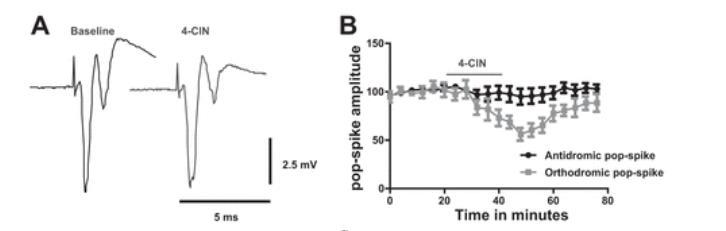
圖2:乳酸抑制的耗氧效應,"4-CIN處理組(紅色)較對照組(黑色)的耗氧幅度降低,基線氧分壓升高,*p<0.001"
總結
本研究揭示癲癇腦組織中病理性乳酸累積通過單羧酸轉運體(MCT4)維持異常放電的惡性循環機制,低濃度乳酸(1.8±0.3 mM,經Unisense微電極系統精確測定)在激活腺苷A1受體的同時抑制能量代償通路,驅動癲癇風暴形成。Unisense氧敏感微電極憑借其10微米級空間分辨率與毫秒級時間精度,首次捕捉到乳酸轉運抑制后耗氧峰降低20%(動物模型)至30%(人源組織)的關鍵代謝證據,并同步驗證氧分壓恢復速率提升2.1倍的代償效應,為解析乳酸雙向調控機制提供了不可替代的動態監測窗口。研究同時發現鈣非依賴途徑——乳酸阻斷通過KATP通道激活實現自主抗癲癇效應,這一現象與MCT4介導的星形膠質細胞-神經元乳酸穿梭形成病理能量引擎的矛盾現象,凸顯濃度閾值效應的關鍵作用。未來需借助Unisense梯度測量技術繪制"乳酸濃度-放電頻率"劑量曲線,并開發多參數微電極陣列同步監測乳酸/氧/pH的動態耦合關系,以破解代謝風暴的時空傳播路徑;尤其在新型MCT抑制劑臨床試驗中植入微電極實時評估代謝重塑效應,將為閉環治療提供理論錨點。當微電極的探針成為代謝顯微鏡,乳酸在癲癇中的雙面調控密碼終顯形于濃度梯度毫厘之變——這把開啟精準干預的鑰匙,正藏在病理與生理的臨界波動之間。