熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Insights into the Production and Role of Nitric Oxide in the Antarctic Sea-ice Diatom Fragilariopsis cylindrus
南極海冰硅藻柱狀脆桿藻中一氧化氮的產生及作用研究
來源:Journal of Phycology,Volume56, Issue5,October 2020,Pages 1196-1207
《藻類學雜志》,第56卷,第5期,2020年10月,第1196-1207頁
摘要
摘要闡述了南極海冰硅藻柱狀脆桿藻(Fragilariopsis cylindrus)中一氧化氮(NO)的產生機制及其生理作用。通過微傳感器、微流體室和人工海冰槽等技術,發現NO的產生依賴于亞硝酸鹽(NO??)并通過硝酸還原酶(NR)途徑。光照會抑制NO產生,但當光合電子傳遞受阻(如添加抑制劑DCMU)時,光照下仍可誘導NO生成。外源NO會抑制藻細胞生長、破壞光合作用并改變非光化學淬滅機制。環境脅迫(鹽度、溫度變化)也會觸發NO產生,表明NO可能作為"脅迫信號"分子參與細胞響應。
研究目的
1. 確定柱狀脆桿藻中NO產生的主要酶促途徑。
2. 探究海冰相關非生物因素(如溫度、鹽度)是否影響NO產生。
3. 評估外源NO對藻細胞光生理學的影響。
研究思路
1. 核心方法: 使用微流體室結合丹麥Unisense公司生產的Clarke型NO微電極(NO-100μm),在精確控制的微環境中實時原位監測細胞尺度上的NO動態變化。
2. 生化途徑驗證: 在微流體室中向細胞施加不同氮源(亞硝酸鹽、硝酸鹽、L-精氨酸)及特定抑制劑(如NOS阻斷劑L-NAME、NO清除劑血紅蛋白Hb),通過電極信號變化判斷NO來源途徑。
3. 光調控研究: 在微流體室中精確控制光照條件(黑暗、低光、高光),并結合光合抑制劑DCMU處理,研究光照及光合電子傳遞對NO產生的影響。
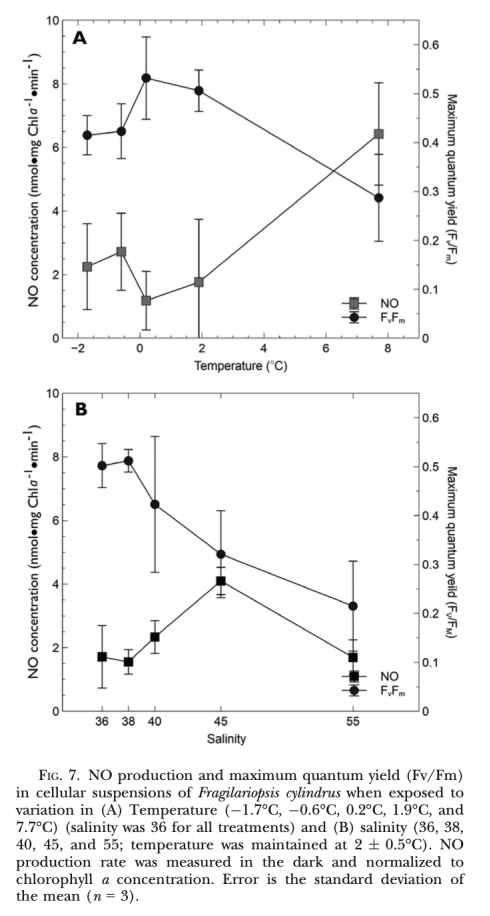
4. 環境脅迫模擬: 使用溫度梯度裝置和鹽度調節培養液,測量不同溫度(-1.7°C至7.7°C)和鹽度(36至55)脅迫下細胞內的NO產量(同樣使用Unisense電極在黑暗條件下測量)。
5. 外源NO效應: 使用NO供體SNAP處理藻細胞,利用調制葉綠素熒光儀(Water-PAM)測量其對光合效率(Fv/Fm)、相對電子傳遞速率(rETRmax)、光化學淬滅(qP)及非光化學能量耗散組分(ΦII, ΦNPQ, ΦNO)的影響,并檢測其對細胞生長和ATP含量的影響。
6. 生態關聯驗證: 在人工倒置海冰槽中模擬海冰環境,嵌入培養柱進行平行實驗,比較與實驗室微流體結果的差異。
測量的數據及研究意義
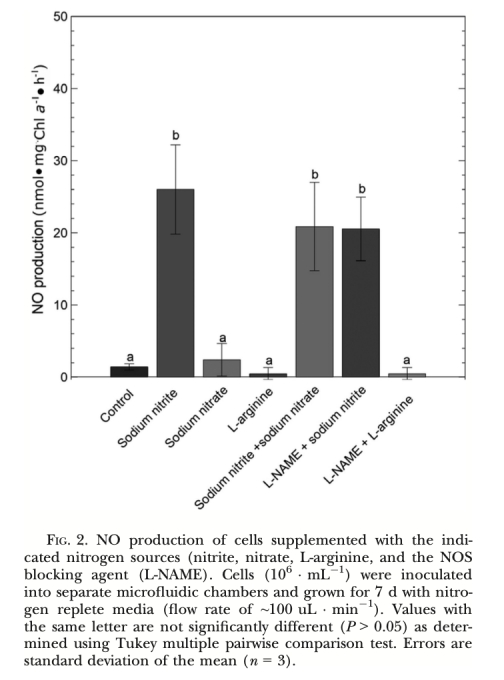
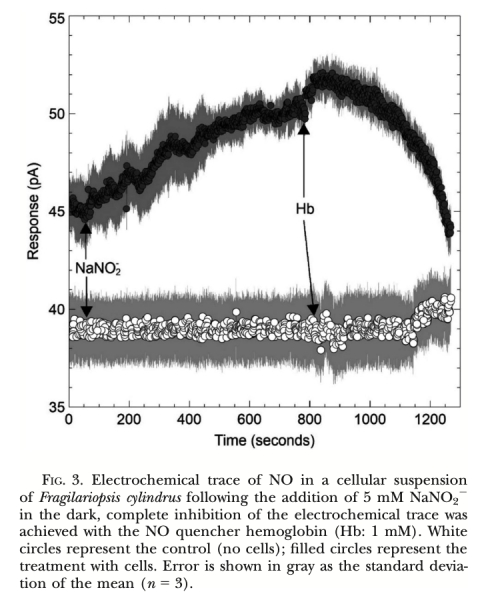
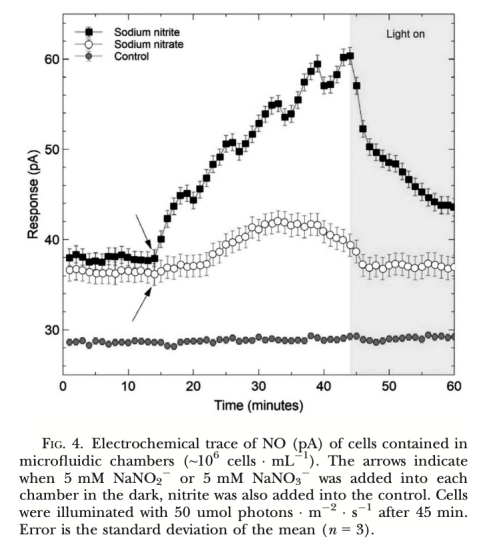
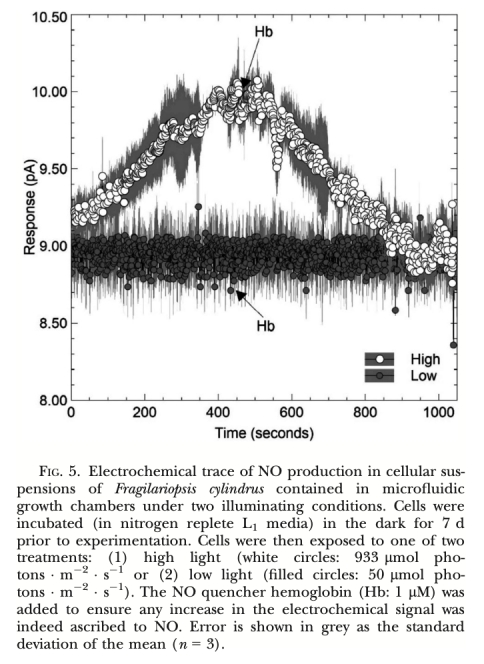
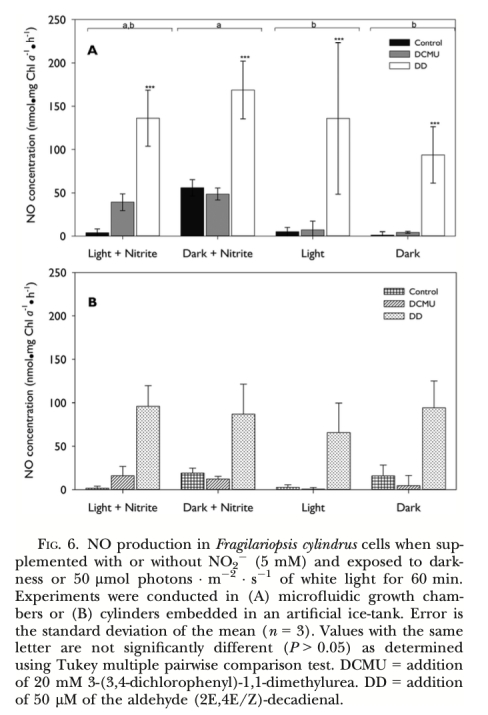
1. NO產生速率 (圖2, 圖3, 圖4, 圖5, 圖6, 圖7): 使用Unisense電極測量。意義: 直接量化不同處理(氮源、光照、抑制劑、溫度、鹽度)下細胞產生的NO量,是確定產生途徑和環境響應的核心證據。圖2/圖3證明亞硝酸鹽依賴的NR途徑是主要來源;圖4/圖5/圖6證明光抑制及其與光合電子鏈的關聯;圖7證明溫鹽脅迫的誘導作用。
2. 光合參數:
? Fv/Fm (最大量子產量,圖7A, 圖8A): 反映PSII最大光化學效率。意義: 指示光合機構整體健康狀況,溫鹽脅迫(圖7A)和外源NO(圖8A)均顯著降低Fv/Fm,表明脅迫損傷。
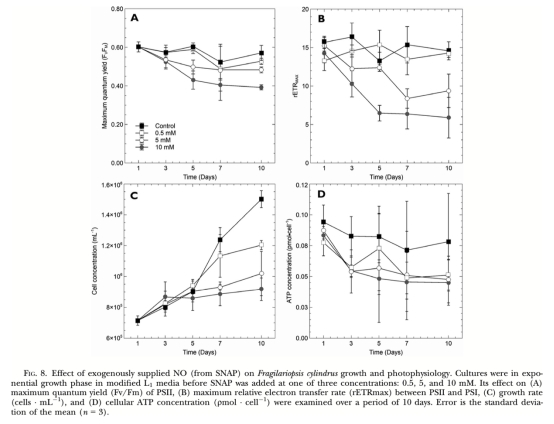
? rETRmax (最大相對電子傳遞速率,圖8B): 反映PSII到PSI的電子傳遞鏈最大能力。意義: 外源NO顯著抑制rETRmax(圖8B),表明NO干擾了光合電子傳遞。
? qP (光化學淬滅,圖9A): 反映PSII反應中心開放程度(QA氧化態)。意義: 外源NO顯著降低qP(圖9A),表明NO導致反應中心“關閉”,阻礙電子從QA向QB傳遞。
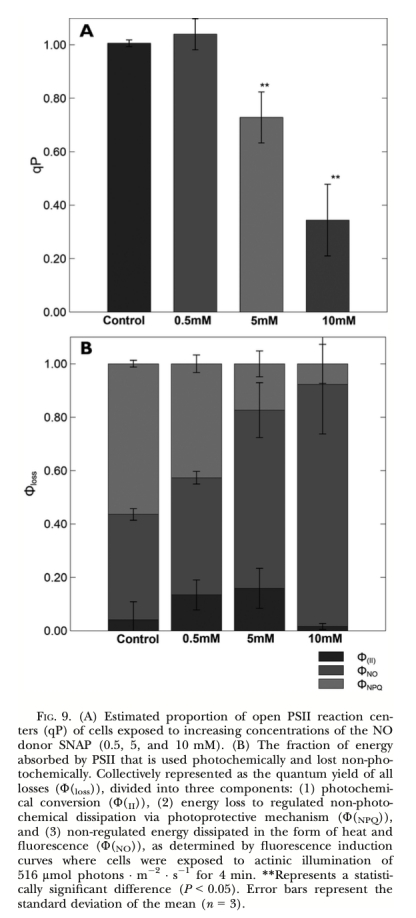
? 能量分配組分 (ΦII, ΦNPQ, ΦNO, 圖9B): 分別代表用于光化學轉化的能量、通過調節機制耗散的能量、非調節性耗散的能量。意義: 外源NO降低ΦNPQ而增加ΦNO(圖9B),表明NO破壞了依賴類胡蘿卜素/葉黃素循環的調節性能量耗散機制,導致更多能量以非調節性方式(可能造成損傷)耗散。
3. 生長數據 (細胞濃度,圖8C): 意義: 外源NO顯著抑制藻細胞生長(圖8C),證明其對細胞增殖有毒性。
4. ATP含量 (圖8D): 意義: 高濃度外源NO(10mM SNAP)導致細胞ATP含量下降(圖8D),但下降程度小于光合抑制程度,提示可能存在補償機制或測量靈敏度限制。
結論
1. 產生機制: 柱狀脆桿藻的NO產生主要依賴亞硝酸鹽(NO??)途徑,由硝酸還原酶(NR) 催化。未檢測到L-精氨酸-NOS途徑的證據。光照通過維持活躍的光合電子流(促進亞硝酸鹽同化)抑制NO產生。光合電子傳遞受阻(如黑暗、DCMU處理、高光脅迫)導致亞硝酸鹽積累并觸發NR介導的NO產生。
2. 環境響應: 溫度升高(>0°C,尤其是7.7°C)和高鹽脅迫(>38)均可誘導NO產生,同時伴隨光合效率(Fv/Fm)下降,表明NO產生與環境脅迫密切相關。藻源醛類(DD)也能強烈誘導NO產生。
3. 生理作用: 高濃度的外源NO具有負面生理效應:抑制細胞生長、抑制PSII最大光化學效率(Fv/Fm)和電子傳遞速率(rETRmax)、導致PSII反應中心關閉(qP下降)、擾亂調節性能量耗散機制(ΦNPQ下降,ΦNO上升)、降低細胞ATP水平。在脅迫條件下產生的內源NO可能作為“脅迫信號”分子參與細胞生理調節或程序性死亡信號通路。
使用丹麥Unisense電極測量數據的研究意義
使用丹麥Unisense公司生產的NO-100μm Clarke型微電極進行測量,其研究意義至關重要且獨特:
1. 實時原位高分辨率監測: 該電極允許在微米尺度上(距離細胞約50-100μm),對活體細胞在其生長的微環境(微流體室、海冰槽模擬環境)中進行實時、連續的NO濃度變化監測(如圖3、圖4、圖5、圖6)。這種原位監測能力避免了傳統方法(如化學檢測培養上清液)可能帶來的樣本破壞、時間滯后和空間分辨率低的問題。
2. 驗證生化途徑的核心工具: 通過精確添加底物(如NO??)和特異性抑制劑/清除劑(如Hb),并結合電極信號的即時、顯著變化(如圖3:添加Hb后NO信號被快速淬滅;圖2:添加NO??后信號顯著升高),該技術為確定NO產生的主要生化途徑(亞硝酸鹽-NR途徑) 和排除其他途徑(精氨酸-NOS途徑) 提供了最直接、有力的電化學證據。其高靈敏度能可靠檢測到低至pA級別的電流變化(如圖4, 圖5)。
3. 揭示光調控動態的關鍵: 微電極能夠捕捉NO產生對光照狀態轉換的快速響應(如圖4:光照開始后NO信號迅速下降)。結合光照條件的精確控制和光合抑制劑的使用(如圖6),它清晰地證明了光合電子流狀態對NO產生的動態開關作用(光照抑制,電子傳遞受阻則誘導)。這在批量培養的化學檢測中難以實現如此精確的時序關聯。
4. 量化環境脅迫響應: 在模擬環境脅迫(溫度梯度、鹽度變化)實驗中(圖7),微電極能夠高靈敏度地量化不同脅迫程度下細胞產生的NO量。這種定量關系(如溫度升高/鹽度增加與NO產量上升)是建立NO作為脅迫生物標志物或信號分子假設的基礎數據。
5. 驗證生態相關性: 通過在海冰槽模擬環境中(圖6B)使用同款電極進行測量,雖然產量較低,但觀察到了與微流體室實驗一致的NO產生模式(如對NO??和DCMU的響應)。這提示實驗室微環境結果具有生態意義,同時微電極也揭示了不同環境(開放式vs封閉式)可能影響NO累積水平。
6. 高特異性與可靠性: 使用NO清除劑血紅蛋白(Hb)可特異性淬滅電極檢測到的信號(如圖3, 圖5),這強有力地證明了所測信號確實源于NO本身,而非其他可能的電化學干擾物質,確保了數據的可靠性和特異性。
綜上所述,丹麥Unisense NO微電極是該研究不可或缺的核心技術平臺,其高時空分辨率、特異性、靈敏度和原位監測能力,使得研究者能夠首次在細胞微環境水平上清晰地描繪出南極硅藻柱狀脆桿藻NO產生的生化途徑、調控機制及其對環境脅迫的響應動態。