熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Fungal biofilm architecture produces hypoxic microenvironments that drive antifungal resistance
真菌生物膜結構產生低氧微環境,驅動抗真菌耐藥性
來源: PNAS | September 8, 2020 | vol. 117 | no. 36 | 22473–22483
1. 摘要核心內容
論文揭示了絲狀真菌生物膜抗藥性的新機制:
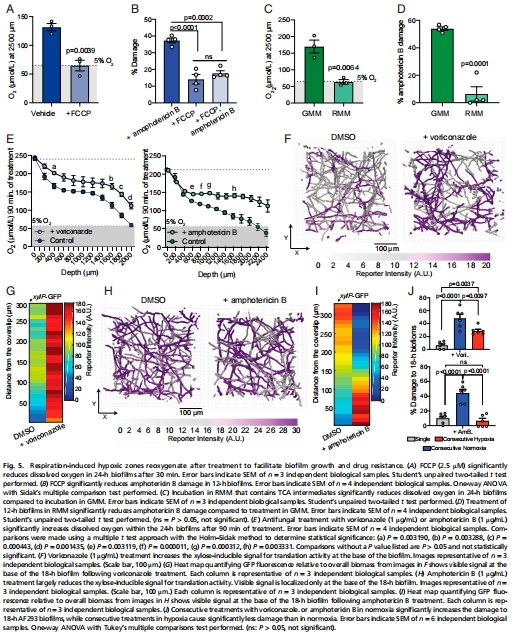
核心發現:煙曲霉(Aspergillus fumigatus)生物膜在成熟過程中自發形成缺氧微環境(圖2),這種缺氧狀態驅動生物膜對抗真菌藥物(如伏立康唑、兩性霉素B)產生耐藥性(圖4)。
機制解析:
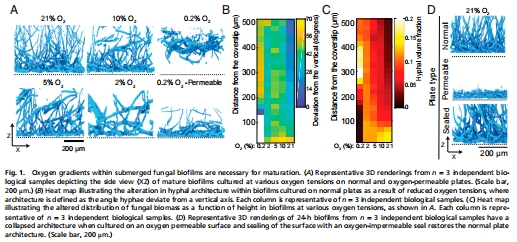
生物膜的垂直菌絲結構消耗氧氣,導致基底缺氧(圖1D);
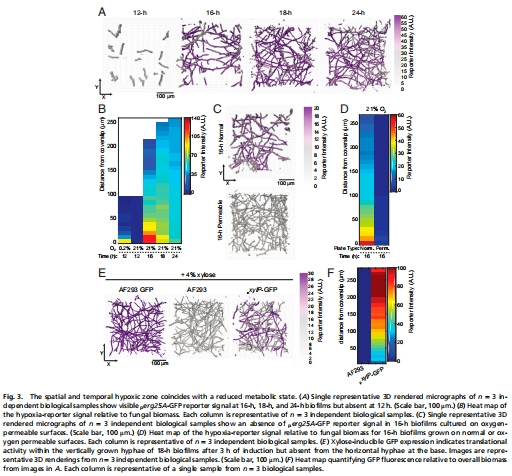
缺氧區域細胞代謝活性降低(圖3E-F),成為耐藥細胞庫;
增氧處理(如氧滲透板)可顯著增強藥物敏感性(圖4E)。
意義:缺氧微環境是細菌和真菌生物膜耐藥的共同機制,為克服抗真菌耐藥提供了新靶點。
2. 研究目的
解決關鍵科學問題:
1.耐藥性矛盾:為何體外藥敏試驗敏感的煙曲霉在體內感染中治療失敗?
2.生物膜特性:絲狀真菌生物膜的獨特結構(開放菌絲網絡)如何影響缺氧微環境形成?
3.機制空白:缺氧微環境是否直接導致抗真菌耐藥?其分子機制是什么?
3. 研究思路
采用多尺度驗證策略:
1.模型構建:
體外培養煙曲霉生物膜(正常板 vs. 氧滲透板);
對比不同氧濃度(21% O? vs. 0.2% O?)對生物膜結構的影響(圖1A-C)。
2.缺氧可視化:
構建缺氧報告菌株(p<sub>erg25A</sub>-GFP),實時監測缺氧區域(圖3A-B);
丹麥Unisense微電極定量生物膜內溶解氧梯度(圖2A-B)。
3.耐藥性驗證:
藥敏試驗(XTT法)檢測伏立康唑/兩性霉素B對生物膜的殺傷效果(圖4);
基因敲除株(ΔsrbA, ΔsrbB)驗證缺氧響應通路的作用(圖2D)。
4.機制探索:
翻譯活性報告菌株(p<sub>xylP</sub>-GFP)定位代謝靜止細胞(圖3E-F);
呼吸增強劑(FCCP)和三羧酸循環(TCA)中間體調控缺氧(圖5)。
4. 測量數據及研究意義
(1)生物膜結構與氧梯度(圖1-2)
數據:
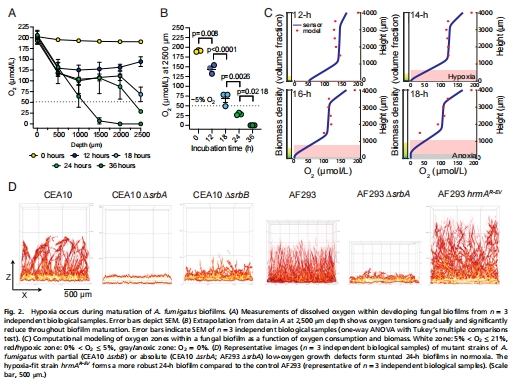
微電極測量顯示:生物膜深層(2.5 mm)氧濃度從21%降至近0%(圖2B);
計算模型預測缺氧區(O? ≤ 5%)在14-16小時形成(圖2C)。
意義:首次證實絲狀真菌生物膜自發形成三維氧梯度,顛覆“開放結構無缺氧”的認知。
(2)缺氧與代謝靜止(圖3)
數據:
p<sub>erg25A</sub>-GFP報告基因顯示基底缺氧(圖3B);
p<sub>xylP</sub>-GFP揭示基底菌絲翻譯活性降低(圖3F)。
意義:缺氧區域細胞進入代謝靜止狀態,成為耐藥細胞庫。
(3)缺氧驅動耐藥(圖4-5)
數據:
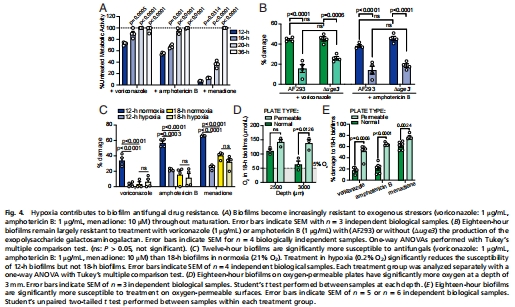
成熟生物膜(18 h)耐藥性顯著高于未成熟生物膜(12 h)(圖4A);
增氧處理(氧滲透板)使兩性霉素B殺傷率↑45%(圖4E);
呼吸增強劑FCCP加劇缺氧,降低藥物敏感性(圖5B)。
意義:缺氧是獨立于胞外基質的耐藥新機制,靶向缺氧可逆轉耐藥。
(4)治療啟示(圖5J)
數據:
連續給藥在常氧下增效,但在缺氧下失效(圖5J);
抗真菌藥物處理后氧濃度反常上升(圖5E),提示殺死耗氧菌體。
意義:臨床需聯合增氧策略(如高壓氧)以增強抗真菌療效。
5. 結論
1.缺氧是耐藥核心驅動力:煙曲霉生物膜通過菌絲呼吸消耗氧氣,形成基底缺氧微環境,誘導代謝靜止和耐藥;
2.結構-功能關聯:垂直菌絲朝向氧源生長(“趨氧性”)是缺氧微環境形成的前提;
3.治療新策略:破壞缺氧微環境(如氧滲透材料、呼吸抑制劑)可克服生物膜耐藥;
4.進化保守性:缺氧耐藥機制在細菌和真菌中保守存在,是跨物種抗菌新靶點。
6. 丹麥Unisense電極的研究意義
技術應用背景(Materials and Methods部分)
"Dissolved oxygen was quantified using a Unisense Oxygen Measuring System... with a 25-μm Clark-type sensor"
核心貢獻:
1.高分辨率氧測繪:
實現空間分辨率200-500 μm的溶解氧動態監測(圖2A);
首次直接證實生物膜深層氧濃度梯度(基底O? ≈ 0%),推翻“菌絲間隙無擴散限制”假說。
2.關鍵機制驗證:
發現抗真菌藥物升高氧濃度(圖5E),證明藥物主要殺死耗氧菌體,殘留缺氧細胞存活;
證實呼吸增強劑FCCP加劇缺氧(圖5A),確立真菌呼吸消耗與缺氧的因果關系。
3.技術優勢與局限:
優勢:微創實時監測,支持復雜三維結構分析;
局限:電極脆弱(深度>3 mm時易損),無法穿透致密菌絲區。
領域價值:為微生物生物膜研究提供了金標準氧檢測工具,推動缺氧靶向抗菌策略發展。