熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Modification of oxygen consumption and blood flow in mouse somatosensory cortex by cell-type-specific neuronal activity
細胞類型特異性神經元活動對小鼠體感皮層耗氧量和血流的改變
來源:Journal of Cerebral Blood Flow & Metabolism 2020, Vol. 40(10) 2010–2025
1. 論文摘要核心內容
本研究通過光遺傳學技術特異性激活皮層PV中間神經元和錐體神經元,探究γ振蕩(gamma activity)與腦氧代謝率(CMRO?)的關系:
核心發現:CMRO?反應取決于神經元激活本身,而非γ活動功率(圖6)。光遺傳激活PV中間神經元可獨立誘導CMRO?和腦血流(CBF)反應,但γ活動本身并非能量消耗的直接驅動因素。
關鍵機制:
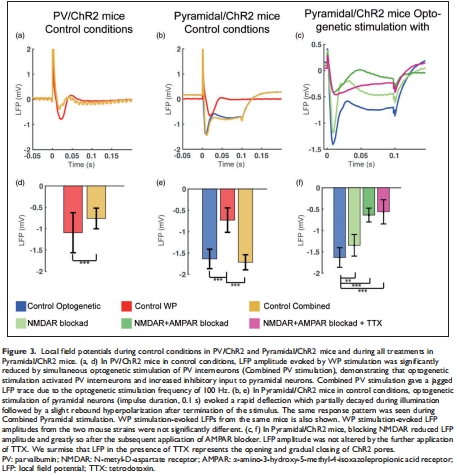
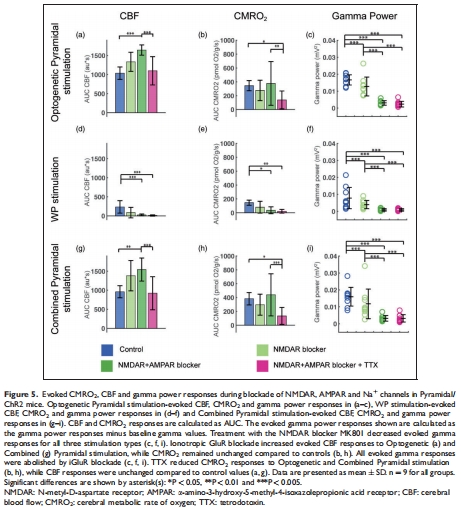
錐體神經元激活是γ振蕩產生的必要條件(圖3, 5);
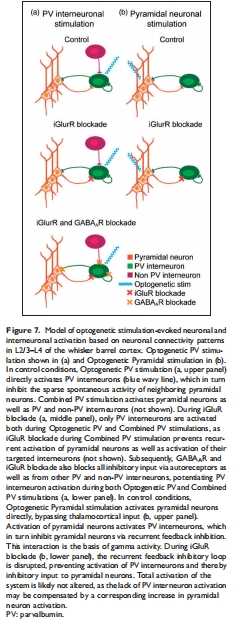
共興奮-抑制(如PV中間神經元抑制錐體神經元)不增強能量消耗(圖4, 7);
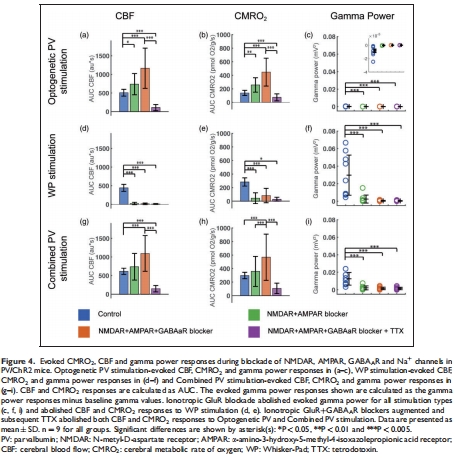
CMRO?主要反映電壓門控鈉通道活動(圖4, 5)。
創新點:首次在細胞類型分辨率下證明神經元興奮而非節律活動是腦能量消耗的核心驅動因素。
2. 研究目的
1.驗證假說:γ振蕩(30-90 Hz)是否直接驅動高能量消耗?PV中間神經元激活是否通過共興奮-抑制增強氧耗?
2.解析機制:明確PV中間神經元在神經血管耦合(CBF-CMRO?匹配)中的作用。
3.技術突破:結合光遺傳學與丹麥Unisense微電極,實現細胞類型特異性的CMRO?動態監測。
3. 研究思路
1.動物模型:
轉基因小鼠:PV-ChR2(PV中間神經元特異性表達光敏感通道)、Pyramidal-ChR2(錐體神經元特異性表達)。
刺激方式:光遺傳激活PV/錐體神經元、觸須墊刺激(Whisker-Pad, WP)、聯合刺激(圖1c-g)。
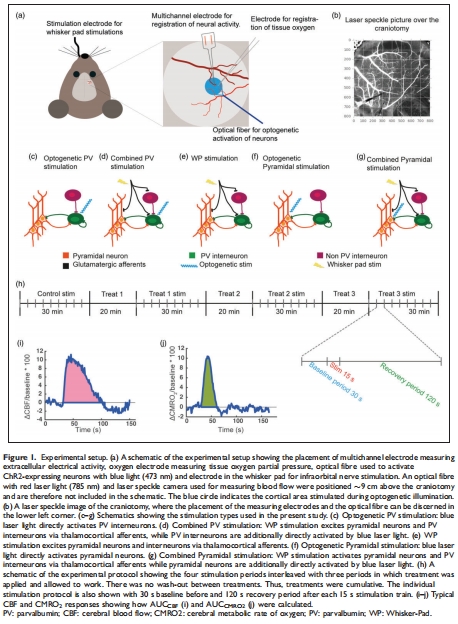
2.干預手段:
藥理學阻斷:NMDAR/AMPAR(谷氨酸受體)、GABAAR、電壓門控鈉通道(TTX)。
3.多模態監測:
丹麥Unisense電極:實時測量局部組織氧分壓(tpO?),計算CMRO?(方法2.6);
激光散斑成像(LSCI):腦血流(CBF)動態;
電生理:局部場電位(LFP)及γ功率分析。
4. 關鍵數據及研究意義
(1) PV中間神經元激活獨立驅動CMRO?(圖2, 4)
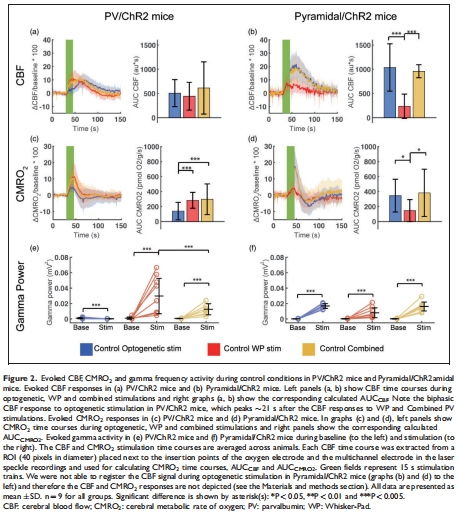
數據:
光遺傳激活PV神經元誘導顯著CMRO?上升(ΔCMRO? ≈ 40%,圖2c);
iGluR/GABAAR阻斷后CMRO?反應仍存在,TTX阻斷后消失(圖4a-b),證明其依賴電壓門控鈉通道。
意義:PV神經元自身活動即可消耗氧氣,無需錐體神經元參與,推翻“抑制性神經元僅通過抑制消耗能量”的傳統認知。
(2) γ振蕩與CMRO?解離(圖6)
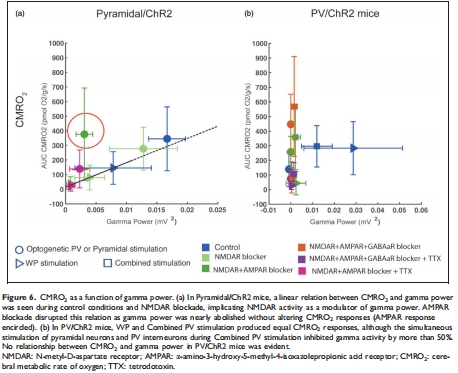
數據:
錐體神經元激活時,γ功率與CMRO?呈正相關(圖6a);
但AMPAR阻斷后γ功率↓80%而CMRO?不變(圖6a紅圈);PV激活時γ↓50%但CMRO?不變(圖6b)。
意義:γ活動是能量消耗的伴隨現象而非原因,顛覆“γ振蕩是高能耗過程”的假說。
(3) 共興奮-抑制不增強能量消耗(圖4g-h, 7)
數據:聯合刺激(WP+PV光遺傳)抑制錐體神經元活動(LFP↓50%,圖3a),但CMRO?與單純WP刺激無差異(圖4g-h)。
意義:反駁“興奮-抑制平衡增強跨膜離子通量”的理論(圖7模型),表明抑制性輸入不額外增加氧耗。
(4) 神經血管解耦現象(圖5)
數據:
iGluR阻斷后,錐體神經元光遺傳刺激的CBF↑但CMRO?不變(圖5a-b);
TTX阻斷后CMRO?↓但CBF不變(圖5h)。
意義:CBF與CMRO?可短暫解耦,提示血流反應可能受非代謝因素(如神經遞質)調控。
5. 丹麥Unisense電極的核心價值
(1) 技術原理
功能:高時空分辨率測量皮層氧分壓(tpO?)(方法2.6),結合CMRO?計算模型量化腦氧代謝率。
參數:
尖端直徑10 μm,空間分辨率20 μm(精準定位L2/3層);
采樣率100 Hz → 1 Hz(降噪保真)。
(2) 關鍵發現(圖2c-d, 4, 5b)
細胞類型特異性CMRO?動態:
PV神經元激活后tpO?快速下降(圖2c),直接證明其獨立耗氧能力;
錐體神經元激活后CMRO?反應依賴鈉通道(TTX阻斷后↓66%,圖5b)。
γ振蕩與氧耗解耦的直接證據:
AMPAR阻斷后γ功率消失但tpO?動態不變(圖5b vs 圖6a),為“γ非耗能主因”提供原位證據。
(3) 研究意義
機制解碼:
推翻“γ振蕩驅動高能耗”假說,確立神經元興奮為氧耗核心;
揭示PV神經元自身代謝需求,修正抑制性神經元功能模型。
技術優勢:
精準性:微米級空間分辨率避免組織平均效應;
動態性:秒級監測捕捉瞬態氧代謝變化;
不可替代性:傳統fMRI/BOLD無法區分細胞類型特異性代謝。
6. 結論
1.γ振蕩本質:神經元興奮的副產品,非獨立耗能過程。
2.PV神經元作用:自身活動直接耗氧,抑制錐體神經元不額外增加能量需求。
3.神經血管耦合:CBF與CMRO?可解耦,血流反應或受非代謝信號調控。
4.Unisense電極貢獻:
實現細胞類型分辨的CMRO?動態解析;
為“神經元興奮驅動能量消耗”提供直接實驗證據;
推動神經代謝研究從宏觀向細胞尺度深化。
總結
本研究通過丹麥Unisense電極的高精度氧監測,結合光遺傳學與多模態技術,首次闡明:
1.能量消耗的核心是神經元興奮(電壓門控鈉通道活動),而非網絡節律(如γ振蕩);
2.PV中間神經元是代謝主動單元,其抑制功能不額外增加氧耗;
3.Unisense技術的不可替代性:
揭示細胞類型特異性氧代謝動力學;
為神經能量分配理論提供定量依據;
奠定精準解析腦能量代謝的技術基石。
該研究重塑了對腦能量預算的基本認知,Unisense電極在此過程中發揮了關鍵的機制解碼器作用。