熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Efficacy-shaping nanomedicine by loading Calcium Peroxide into Tumor Microenvironment-responsive Nanoparticles for the Antitumor Therapy of Prostate Cancer
通過將過氧化鈣負(fù)載到腫瘤微環(huán)境響應(yīng)納米顆粒中用于前列腺癌的抗腫瘤治療
來源:Theranostics 2020, Vol. 10, Issue 21
1. 論文摘要核心內(nèi)容
本研究開發(fā)了一種基于腫瘤微環(huán)境(TME)響應(yīng)型納米系統(tǒng)(CaO?@HMSNs-PAA),用于前列腺癌靶向治療:
載體設(shè)計:中空介孔二氧化硅納米顆粒(HMSNs)負(fù)載過氧化鈣(CaO?),表面包覆聚丙烯酸(PAA)作為pH響應(yīng)門控。
作用機(jī)制:酸性TME(pH≈6.5)觸發(fā)CaO?釋放H?O?,在腫瘤細(xì)胞內(nèi)生成高濃度活性氧(ROS),通過線粒體凋亡通路誘導(dǎo)癌細(xì)胞死亡。
療效優(yōu)勢:顯著抑制前列腺癌細(xì)胞(PC-3)增殖(體外存活率降至42.6%),在動物模型中腫瘤體積縮小58%,且對正常組織無損傷。
創(chuàng)新概念:提出“療效重塑納米醫(yī)學(xué)”(Efficacy-shaping Nanomedicine),將無活性的CaO?轉(zhuǎn)化為TME響應(yīng)型抗腫瘤制劑。
2. 研究目的
1.解決臨床痛點(diǎn):傳統(tǒng)放化療缺乏腫瘤選擇性,副作用大。
2.利用TME特性:基于腫瘤組織酸性環(huán)境(pH 6.5 vs. 正常組織pH 7.4)設(shè)計pH響應(yīng)藥物遞送系統(tǒng)。
3.開發(fā)安全ROS源:通過納米載體實(shí)現(xiàn)CaO?的靶向釋放,避免全身毒性。
3. 研究思路
1.納米系統(tǒng)構(gòu)建(Scheme 2):
合成HMSNs(中空結(jié)構(gòu)提高載藥量)→ 氨基化修飾(HMSNs-NH?)→ 負(fù)載CaO? → PAA涂層(pH響應(yīng)門控)。
2.材料表征(圖1-2):
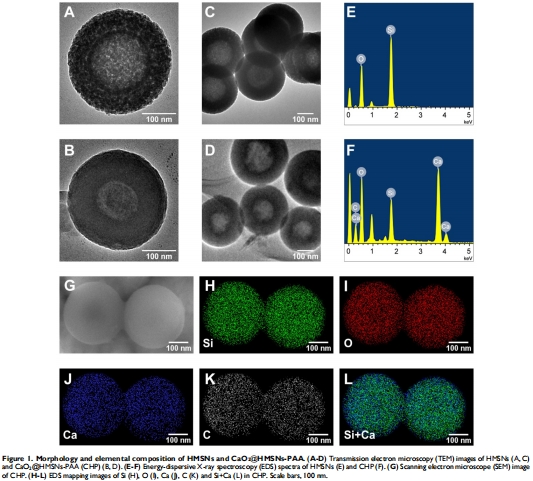
TEM/EDS確認(rèn)HMSNs空腔結(jié)構(gòu)(直徑300nm)及CaO?成功負(fù)載(圖1B,D,F);
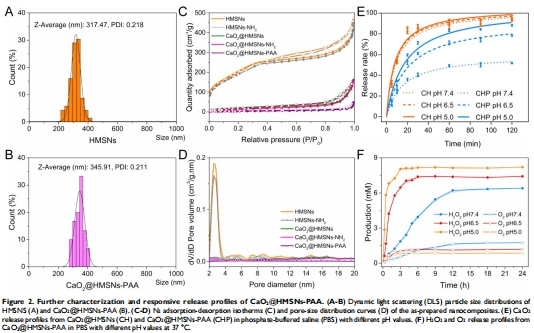
BET分析顯示PAA涂層使比表面積從779m2/g降至12m2/g(圖2C),證明孔道封閉。
3.體外驗證:
釋放動力學(xué):pH 5.0時CaO?釋放率88.2%(vs. pH 7.4時51.7%)(圖2E);
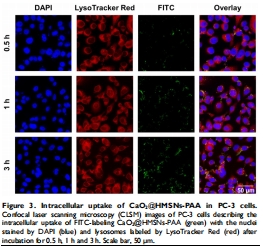
細(xì)胞攝取:CLSM顯示納米顆粒3h內(nèi)富集于溶酶體(圖3);
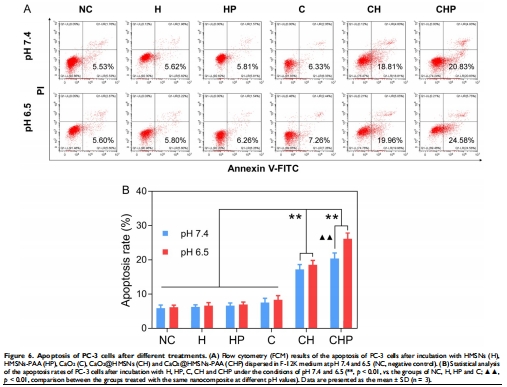
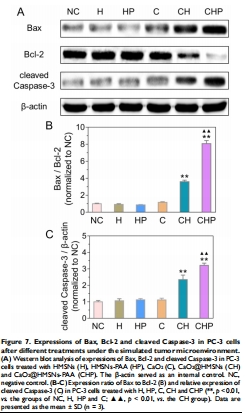
抗腫瘤機(jī)制:ROS誘導(dǎo)線粒體凋亡(Bax/Bcl-2↑,Caspase-3激活)(圖5-7)。
4.體內(nèi)評價:
靶向性:EPR效應(yīng)使腫瘤蓄積量24h達(dá)10.84%(圖8A);
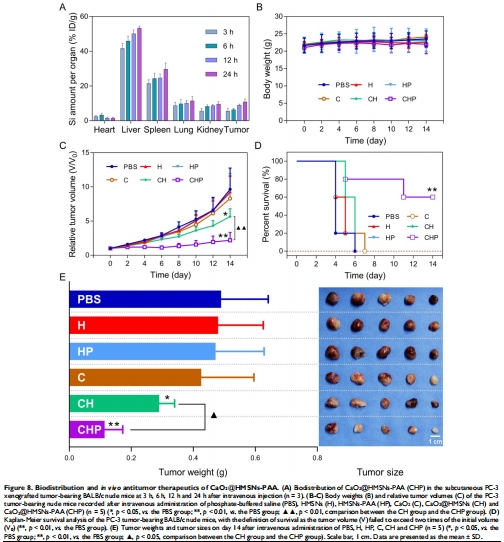
療效:單次給藥后腫瘤體積抑制率58%(圖8C),生存期延長(圖8D)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1) pH響應(yīng)釋放(圖2E-F)
數(shù)據(jù):pH 5.0時CaO?釋放率88.2%(vs. pH 7.4時51.7%);H?O?產(chǎn)量在pH 5.0時為pH 7.4的2.3倍(丹麥Unisense電極測量)。
意義:證實(shí)納米系統(tǒng)在酸性TME中高效釋放ROS,實(shí)現(xiàn)腫瘤選擇性殺傷。
(2) 體外抗腫瘤效果(圖4)
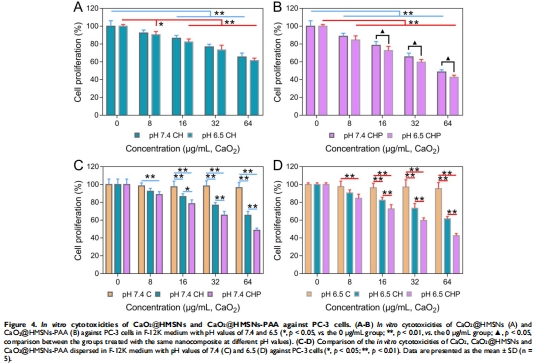
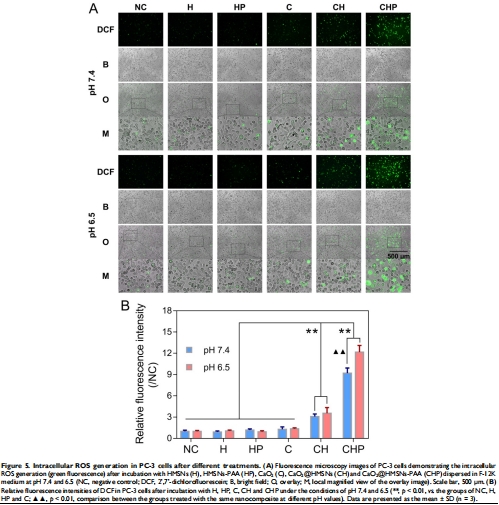
數(shù)據(jù):pH 6.5時,CaO?@HMSNs-PAA使PC-3細(xì)胞存活率降至42.6%(vs. pH 7.4時48.5%);游離CaO?無顯著毒性(存活率96.5%)。
意義:納米載體提升CaO?生物利用度,TME微酸環(huán)境增強(qiáng)療效。
(3) 凋亡機(jī)制(圖6-7)
數(shù)據(jù):
凋亡率26.1%(pH 6.5 vs. 20.4% pH 7.4)(圖6);
Bax/Bcl-2比值升高3倍,Cleaved Caspase-3表達(dá)上調(diào)(圖7)。
意義:ROS通過線粒體通路誘導(dǎo)凋亡,為分子機(jī)制提供證據(jù)。
(4) 體內(nèi)療效(圖8)
數(shù)據(jù):治療組腫瘤重量下降52%(vs. 對照組);H&E染色顯示腫瘤結(jié)構(gòu)破壞(圖S18)。
意義:納米系統(tǒng)實(shí)現(xiàn)靶向治療,避免全身毒性(肝腎功能指標(biāo)正常,圖S13)。
5. 丹麥Unisense電極的核心價值
(1) 技術(shù)原理
功能:實(shí)時監(jiān)測溶液中O?/H?O?濃度動態(tài)變化(方法2.6)。
實(shí)驗設(shè)計:在模擬TME(pH 5.0-7.4)中量化CaO?@HMSNs-PAA的ROS釋放動力學(xué)(圖2F)。
(2) 關(guān)鍵發(fā)現(xiàn)(圖2F)
pH依賴性:酸性環(huán)境(pH 5.0)下H?O?產(chǎn)量顯著升高(pH 5.0 vs. pH 7.4:峰值濃度差2.3倍),而O?生成減少67%。
動力學(xué)曲線:H?O?釋放呈緩釋特征(120min達(dá)平臺期),符合偽零級動力學(xué)。
(3) 研究意義
機(jī)制驗證:直接證明CaO?水解路徑的pH依賴性——酸性環(huán)境促進(jìn)H?O?而非O?生成,為選擇性抗腫瘤提供化學(xué)基礎(chǔ)。
療效優(yōu)化依據(jù):量化ROS釋放效率,指導(dǎo)納米載體設(shè)計(如PAA涂層厚度優(yōu)化)。
技術(shù)優(yōu)勢:相比傳統(tǒng)終點(diǎn)法(如H?O?試劑盒),Unisense提供實(shí)時動態(tài)數(shù)據(jù),揭示時間-濃度關(guān)聯(lián)性,避免采樣誤差。
6. 結(jié)論
1.納米系統(tǒng)有效性:CaO?@HMSNs-PAA通過TME觸發(fā)釋放ROS,顯著抑制前列腺癌生長(體外IC??=16μg/mL,體內(nèi)腫瘤抑制率58%)。
2.安全性:載體材料(HMSNs/PAA)無顯著毒性,正常組織ROS可被抗氧化系統(tǒng)清除。
3.臨床價值:為前列腺癌提供“療效重塑”策略,兼具靶向性、安全性和高效性。
4.Unisense電極貢獻(xiàn):通過精準(zhǔn)量化ROS動力學(xué),為pH響應(yīng)機(jī)制提供不可替代的實(shí)驗證據(jù),推動納米藥物設(shè)計從經(jīng)驗向數(shù)據(jù)驅(qū)動轉(zhuǎn)變。
總結(jié)
本研究通過丹麥Unisense電極的動態(tài)監(jiān)測,結(jié)合多維度實(shí)驗驗證,首次闡明:
1.CaO?的pH響應(yīng)本質(zhì):酸性環(huán)境優(yōu)先生成H?O?(非O?),為腫瘤選擇性氧化損傷奠定基礎(chǔ)。
2.納米載體的核心作用:PAA門控協(xié)同CaO?化學(xué)特性,實(shí)現(xiàn)ROS的時空可控釋放。
3.Unisense技術(shù)的不可替代性:
揭示釋放動力學(xué)細(xì)節(jié),優(yōu)化給藥方案;
提供ROS生成的直接證據(jù),超越間接檢測方法(如熒光探針);
推動納米醫(yī)學(xué)從“定性設(shè)計”邁向“定量調(diào)控”。
該研究為前列腺癌靶向治療提供了新范式,Unisense電極在此過程中發(fā)揮了關(guān)鍵的機(jī)制解碼作用。