熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Differential expression of the five redox complexes in the retinal mitochondria or rod outer segment disks is consistent with their different functionality
視網(wǎng)膜線粒體或視桿外段盤中五種氧化還原復(fù)合物的差異表達與它們的不同功能一致
來源:FASEB BioAdvances. 2020;2:315–324.
1. 論文摘要核心內(nèi)容
本研究通過蛋白質(zhì)組學(xué)與功能分析,揭示了視網(wǎng)膜桿狀外節(jié)(OS)盤膜(無傳統(tǒng)線粒體)進行氧化磷酸化(OxPhos)的分子機制:
關(guān)鍵發(fā)現(xiàn):OS盤表達完整的氧化磷酸化蛋白復(fù)合物(ETC復(fù)合物I-V),其底物利用譜(如檸檬酸、NADH)與線粒體顯著不同(表1、表2)。
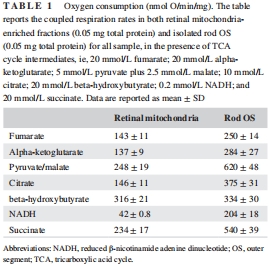
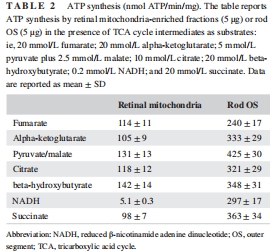
功能差異:OS盤對多種底物(如丙酮酸/蘋果酸)的氧消耗(250–620 nmol O?/min/mg)和ATP合成(240–425 nmol ATP/min/mg)能力高于線粒體(表1、表2)。
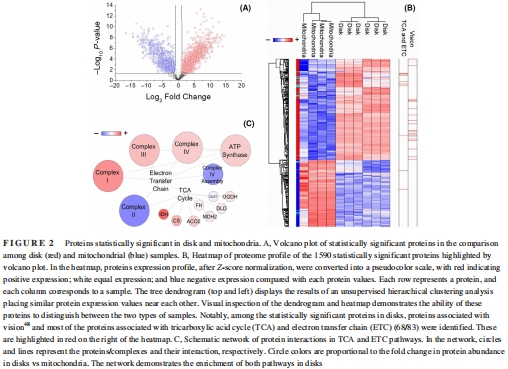
分子基礎(chǔ):蛋白質(zhì)組學(xué)(LC-MS/MS)鑒定出OS盤特異性富集TCA循環(huán)(68/83種蛋白)和ETC復(fù)合物(如復(fù)合物I亞基ND1)(圖2C),而線粒體富集復(fù)合物IV組裝因子(如SCO1、SURF1)。
意義:OS盤的氧化磷酸化能力獨立于線粒體,可能為光轉(zhuǎn)導(dǎo)提供即時ATP,并為視網(wǎng)膜退行性疾病提供新機制視角。
2. 研究目的
1.明確OS盤(無傳統(tǒng)線粒體)進行高效氧化磷酸化的分子基礎(chǔ)。
2.對比OS盤與視網(wǎng)膜線粒體的蛋白表達譜與功能差異,驗證OxPhos蛋白是否為OS盤的固有組分。
3.探究OS盤氧化磷酸化在視網(wǎng)膜能量代謝與疾病中的病理生理意義。
3. 研究思路
1.樣本制備:
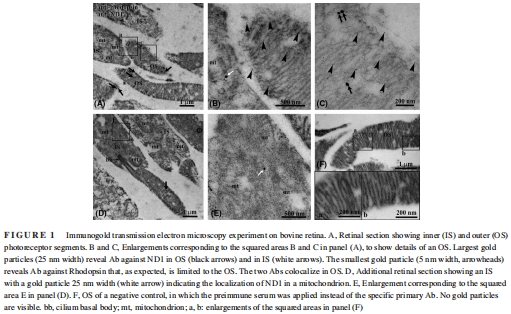
純化牛視網(wǎng)膜OS盤和線粒體,通過Western blot(RHO/ACOX2標記)和電鏡(圖1)驗證純度。
2.功能驗證:
氧消耗與ATP合成:測量OS盤和線粒體對7種底物(如琥珀酸、NADH)的呼吸活性(表1、表2)。
關(guān)鍵數(shù)據(jù):OS盤對NADH的氧消耗(204±18 nmol/min/mg)顯著高于線粒體(42±0.8),ATP合成能力高58倍(表2)。
3.蛋白質(zhì)組學(xué):
LC-MS/MS鑒定3383種蛋白,OS盤特異性富集1171種(如TCA/ETC蛋白),線粒體富集448種(如復(fù)合物IV組裝因子)。
4.生物信息學(xué):
WGCNA分析:紅色模塊(OS盤)與TCA/ETC蛋白強相關(guān)(r>0.7),藍色模塊(線粒體)與丙酮酸/蘋果酸利用相關(guān)。
差異表達:火山圖顯示957種蛋白在OS盤富集(含68種TCA/ETC蛋白),633種在線粒體富集(圖2A)。
5.功能注釋:
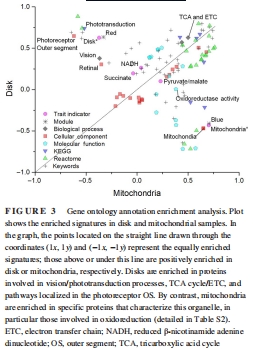
GO分析證實OS盤富集“視覺轉(zhuǎn)導(dǎo)”“TCA循環(huán)”“ETC”通路,線粒體富集“氧化還原”(圖3)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1) 氧消耗與ATP合成(表1、表2)
數(shù)據(jù):OS盤對丙酮酸/蘋果酸的氧消耗(620±48 nmol/min/mg)和ATP合成(425±30 nmol/min/mg)均高于線粒體(248±19;131±13)。
意義:直接證明OS盤具有獨立于線粒體的高效OxPhos能力,為光轉(zhuǎn)導(dǎo)高能量需求提供支撐。
(2) 蛋白質(zhì)組差異(圖2)
數(shù)據(jù):
OS盤富集IDH3(TCA限速酶)、復(fù)合物I亞基(ND1)、ATP合酶亞基(MT-ATP6/8)。
線粒體富集復(fù)合物IV組裝因子(SCO1、SURF1)。
意義:OS盤的OxPhos蛋白非污染物,而是功能組分;其缺乏組裝因子提示蛋白可能由線粒體合成后轉(zhuǎn)運至OS盤。
(3) 功能模塊分析
數(shù)據(jù):WGCNA紅色模塊(OS盤)與多種底物利用強相關(guān)(r=0.58–0.74),藍色模塊(線粒體)僅與丙酮酸/蘋果酸相關(guān)(r=0.71)。
意義:OS盤具有更廣的底物適應(yīng)性,可能適應(yīng)光轉(zhuǎn)導(dǎo)的動態(tài)能量需求。
5. 結(jié)論
1.OS盤是獨立氧化磷酸化單元:表達完整ETC復(fù)合物和TCA酶,高效產(chǎn)生ATP(非線粒體依賴)。
2.功能分化:OS盤偏好多種底物(如NADH、琥珀酸),線粒體依賴丙酮酸/蘋果酸。
3.病理意義:OS盤OxPhos異常可能導(dǎo)致氧化應(yīng)激(如藍光照射),參與視網(wǎng)膜退行疾病(如糖尿病視網(wǎng)膜病變)。
6. 丹麥Unisense電極的核心價值
(1) 技術(shù)應(yīng)用場景
實時氧消耗監(jiān)測:
使用Unisense微呼吸系統(tǒng)(方法2.1.2)測量純化OS盤在封閉腔室中的氧分壓動態(tài)變化(精度達nmol O?/min/mg)。
功能驗證:
直接量化OS盤對7種底物的呼吸活性(表1),為蛋白質(zhì)組數(shù)據(jù)提供功能佐證。
(2) 科學(xué)意義
高靈敏度與實時性:
Unisense電極的微米級探頭和毫秒級響應(yīng)可檢測低至42 nmol O?/min/mg的呼吸速率(表1),精準捕捉OS盤的微弱氧耗。
跨尺度驗證:
電極數(shù)據(jù)與蛋白質(zhì)組(ETC蛋白富集)、功能測定(ATP合成)形成三位一體證據(jù)鏈,確證OS盤的OxPhos能力。
排除污染假說:
電極證實OS盤呼吸活性獨立于線粒體(如對NADH的高響應(yīng)性),排除“線粒體污染”爭議。
(3) 研究啟示
技術(shù)優(yōu)勢:
相比傳統(tǒng)克拉克電極,Unisense的無創(chuàng)微測避免樣本破壞,適用于微量樣本(0.04 mg蛋白)。
疾病模型價值:
電極可監(jiān)測病理條件下(如糖尿病)OS盤氧代謝變化,為氧化應(yīng)激致視網(wǎng)膜損傷提供動態(tài)指標。
總結(jié)
本研究通過Unisense電極的精準氧監(jiān)測,結(jié)合蛋白質(zhì)組學(xué)與生物信息學(xué),首次揭示:
1.OS盤是氧化磷酸化新場所:獨立于線粒體,富集ETC/TCA蛋白(圖2),高效利用多種底物(表1,2)。
2.功能進化意義:為光轉(zhuǎn)導(dǎo)高能量需求提供“就地供能”策略,避免ATP長距離運輸。
3.疾病關(guān)聯(lián):OS盤OxPhos異常可能通過氧化應(yīng)激(如ROI產(chǎn)生)誘發(fā)視網(wǎng)膜退行病變,為治療靶點提供新方向。
Unisense電極的核心貢獻在于:
功能定量:直接驗證OS盤的呼吸活性,支撐“無線粒體的OxPhos”這一顛覆性概念。
技術(shù)不可替代性:其高靈敏度與實時動態(tài)監(jiān)測能力,為亞細胞器代謝研究樹立新標桿。