熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Biomineralized Biohybrid Algae for Tumor Hypoxia Modulation and Cascade Radio-Photodynamic Therapy
生物礦化雜交藻類用于腫瘤缺氧調節和級聯放射光動力治療
來源:ACS Appl. Mater. Interfaces 2020, 12, 44541?44553
1. 論文摘要核心內容
本研究開發了一種新型 生物礦化藻類系統(Algae@SiO?),通過二氧化硅修飾小球藻(Chlorella vulgaris)提升其生物相容性,同時保留光合產氧能力,用于乳腺癌的放療(RT)-光動力(PDT)協同治療:
功能設計:Algae@SiO?通過光合作用在激光照射下原位產氧,緩解腫瘤缺氧并增強放療敏感性;其內源葉綠素可產生ROS實現級聯光動力治療(Scheme 1)。

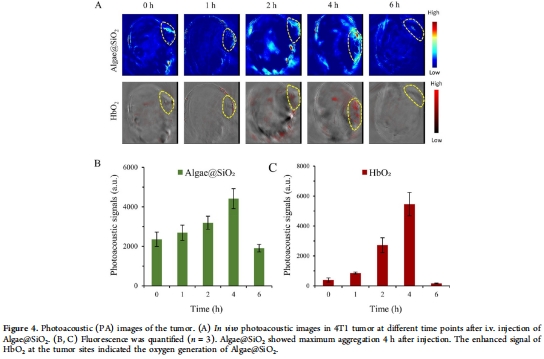
多模態成像:葉綠素賦予Algae@SiO?光聲(PA)和熒光(FI)雙模成像能力,實現腫瘤靶向監測(圖4)。
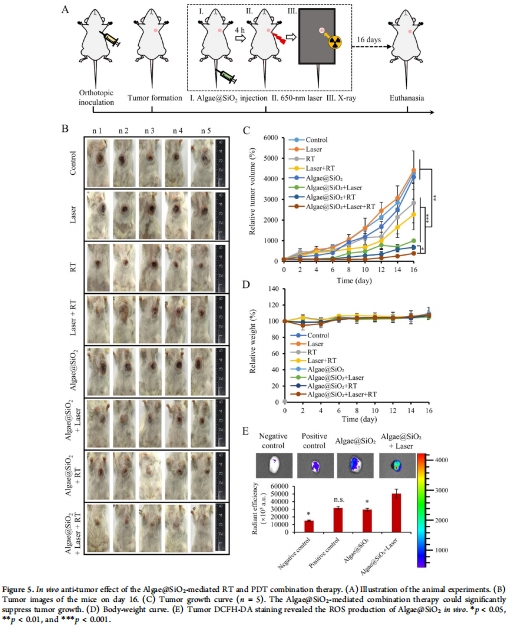
協同療效:在4T1乳腺癌模型中,Algae@SiO?聯合650 nm激光和X射線(6 Gy)顯著抑制腫瘤生長(90%以上)并減少肺轉移(圖5-7)。

核心結論:Algae@SiO?是一種兼具成像、缺氧調控與協同治療的多功能生物系統,為腫瘤治療提供新策略。
2. 研究目的
1.解決腫瘤缺氧導致的放療抵抗問題,開發一種能原位產氧的遞送系統。
2.利用藻類天然葉綠素實現光動力治療,構建放療-光動力協同治療平臺。
3.通過二氧化硅礦化提升藻類生物相容性,延長體內循環時間。
3. 研究思路
1.材料合成:
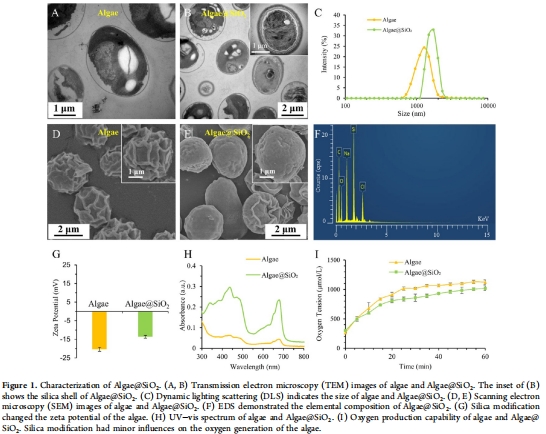
生物礦化修飾:以F127為模板,TEOS/APTES水解在藻表面形成100-200 nm二氧化硅殼(Algae@SiO?),提升穩定性并降低細胞毒性(圖1A-G)。
2.功能驗證:
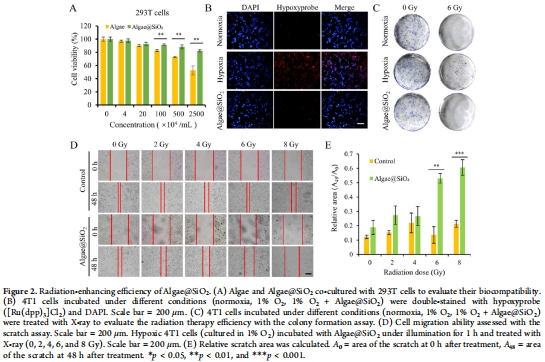
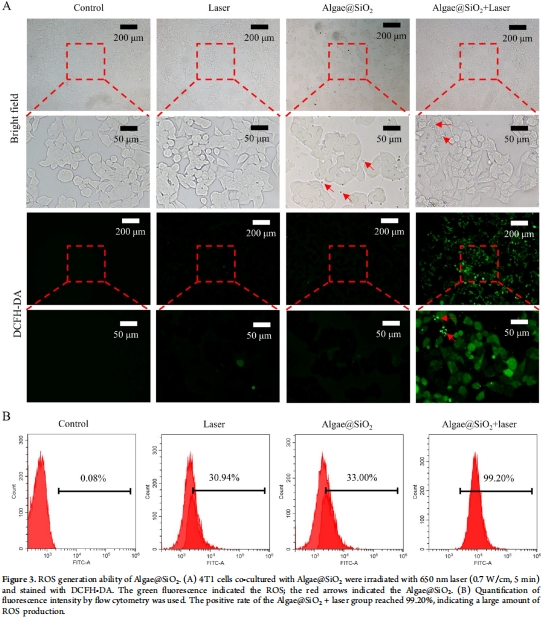
體外:驗證產氧能力(圖1I)、ROS生成(圖3)、放療增敏(圖2C-E)及細胞遷移抑制(圖2D-E)。
體內:通過PA/FI雙模成像示蹤腫瘤靶向(圖4),評估聯合治療(激光+RT)的抗腫瘤效果(圖5-6)。
3.機制探索:
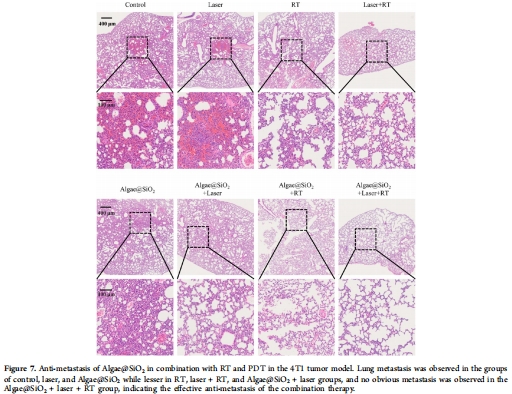
缺氧緩解(HIF-1α↓,圖6G)、血管破壞(CD31↓,圖6F)及轉移抑制(圖7)。
4. 關鍵數據及研究意義
(1) 材料表征(圖1)
數據:
TEM/SEM顯示二氧化硅均勻包覆(圖1B,E),DLS尺寸1.66±0.64 μm(圖1C),zeta電位-13 mV(圖1G)。
意義:礦化修飾顯著降低藻類細胞毒性(293T細胞存活率>95%,圖2A),為體內應用奠定基礎。
(2) 產氧與缺氧緩解(圖1I, 圖4)
數據:
Unisense電極:證實Algae@SiO?維持藻類產氧能力(圖1I)。
PA成像:腫瘤內HbO?信號增強(圖4B-C),表明光合作用提升腫瘤氧合。
意義:直接驗證材料核心功能——通過原位產氧逆轉腫瘤缺氧,增強放療敏感性。
(3) 光動力效應(圖3, 圖5E)
數據:
DCFH-DA染色:Algae@SiO?+激光組ROS陽性率99.2%(圖3B),體內腫瘤ROS顯著升高(圖5E)。
意義:葉綠素作為天然光敏劑,實現級聯PDT,與放療協同殺傷腫瘤細胞。
(4) 抗腫瘤效果(圖5-6)
數據:
聯合治療組(Algae@SiO?+激光+RT)腫瘤體積抑制>90%(圖5C),HIF-1α表達降低(圖6G),肺轉移完全抑制(圖7)。
意義:多模態治療顯著提升療效,證實“缺氧緩解→放療增敏→PDT補殺”的級聯機制。
(5) 生物安全性(圖8)
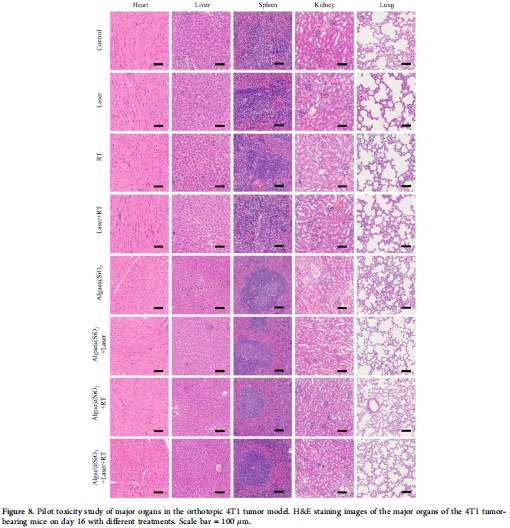
數據:主要器官H&E染色未見病理損傷(圖8),體重穩定(圖5D)。
意義:Algae@SiO?系統具有良好生物相容性,支持臨床轉化潛力。
5. 結論
1.材料創新:二氧化硅礦化成功提升藻類生物相容性,同時保留光合活性與治療功能。
2.治療機制:Algae@SiO?通過光合產氧增敏放療,并利用葉綠素實現PDT,形成協同抗腫瘤效應。
3.應用價值:PA/FI雙模成像指導的聯合治療顯著抑制腫瘤生長與轉移,為實體瘤提供新策略。
6. 丹麥Unisense電極的核心價值
(1) 技術應用場景
體外產氧定量:
使用 Unisense氧微電極 實時監測Algae@SiO?懸浮液的氧分壓動態變化(圖1I)。
細胞缺氧模型驗證:
在1% O?條件下測量Algae@SiO?的氧生成能力(文本未附圖,但為圖2B實驗基礎)。
(2) 科學意義
功能確證:
Unisense數據直接證實礦化修飾 未損害藻類產氧活性(圖1I),消除“二氧化硅殼阻礙氣體交換”的疑慮。
為后續體內PA成像顯示的HbO?升高(圖4C)提供體外機制支撐。
治療邏輯閉環:
氧電極數據是“光合作用→缺氧緩解→放療增敏”理論鏈條的 核心實驗證據,保障級聯治療設計的合理性。
(3) 技術優勢
高靈敏度與實時性:
Unisense電極的 微米級探頭 可無創監測微量氧變化(如細胞懸液),避免傳統氧電極的樣本破壞。
跨尺度驗證:
體外(細胞懸液)與體內(PA成像)數據相互印證,凸顯其在銜接分子機制與活體療效中的 橋梁作用。
總結
本研究通過 Unisense電極的精準氧監測,結合多模態成像與體內外實驗,首次構建了兼具腫瘤靶向、缺氧調控與協同治療的生物礦化藻類系統。其技術貢獻在于:
1.機制可信度保障:Unisense數據(圖1I)為Algae@SiO?的產氧功能提供直接證據,支撐放療增敏理論。
2.治療范式創新:光合產氧聯合葉綠素-PDT,實現“缺氧逆轉→放療增敏→光動力補殺”的級聯治療(Scheme 1)。
3.轉化醫學潛力:材料低毒性(圖8)與顯著抑瘤效果(圖5-7)為臨床開發新型生物雜交系統提供可能。
這一工作不僅拓展了藻類在生物醫學中的應用,也為腫瘤微環境調控提供了創新思路。