熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
The Bioactive Core and Corona Synergism of Quantized Gold Enables Slowed Inflammation and Increased Tissue Regeneration in Wound Hypoxia
量化金的生物活性核心和電暈協(xié)同作用能夠減緩傷口缺氧的炎癥并增加組織再生
來源:Int. J. Mol. Sci. 2020, 21, 1699;
1. 論文摘要核心內(nèi)容
研究開發(fā)了一種新型 量子化金納米復合材料(QG),通過 雙功能協(xié)同機制 促進傷口愈合:
外冠層(Corona)功能:樹狀聚合物捕獲內(nèi)毒素(LPS),減輕炎癥反應(圖1綠色框)。
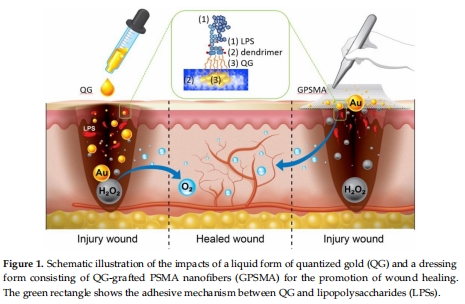
內(nèi)核(Core)功能:金納米簇催化內(nèi)源性過氧化氫(H?O?)分解為氧氣,緩解組織缺氧(圖4)。
兩種應用形式:液態(tài)QG直接注射與QG嫁接的聚苯乙烯-馬來酸酐納米纖維敷料(GPSMA)(圖1)。
動物實驗驗證:QG顯著加速傷口閉合(圖6),GPSMA促進血管生成和膠原沉積(圖7-8)。
2. 研究目的
1.開發(fā)一種同時解決 傷口炎癥(通過LPS清除)和 組織缺氧(通過催化供氧)的雙功能納米材料。
2.驗證QG及其敷料形式(GPSMA)在急慢性傷口模型中的治療效果。
3. 研究思路
1.材料設計與合成:
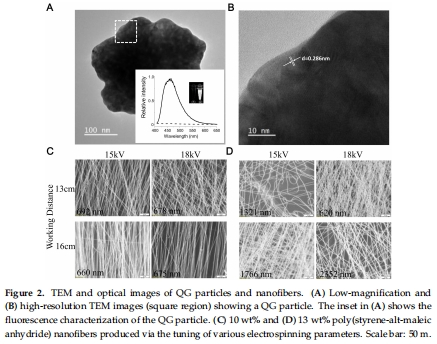
QG由 8原子金納米簇 包裹于樹狀聚合物(PAMAM)中構(gòu)成(圖2A-B)。
GPSMA通過電紡絲制備PSMA納米纖維,再嫁接QG(圖2C-D)。
2.功能驗證:
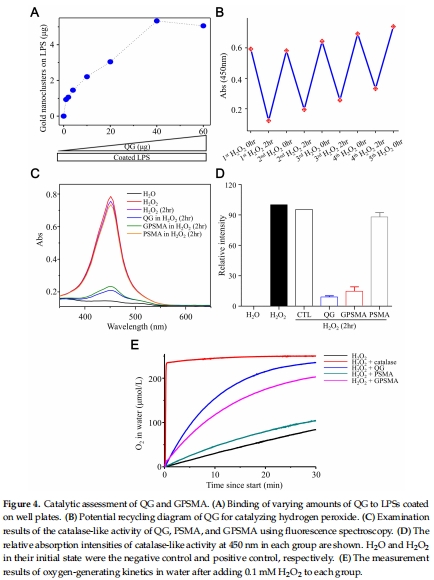
LPS結(jié)合能力:熒光法檢測QG與LPS結(jié)合強度(圖4A)。
催化活性:紫外光譜檢測H?O?分解(圖4B-D),Unisense電極實時監(jiān)測O?生成(圖4E)。
3.體外實驗:
細胞相容性(CCK8檢測,圖5A)。
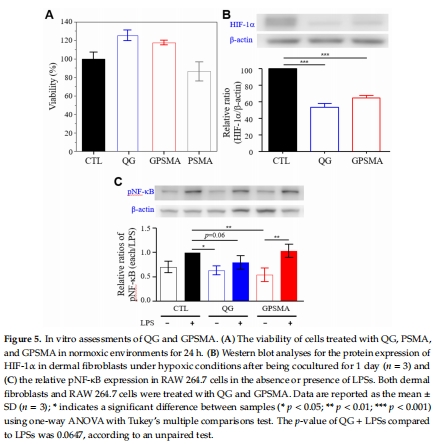
缺氧環(huán)境下HIF-1α表達(Western blot,圖5B)和炎癥因子NF-κB抑制(圖5C)。
4.體內(nèi)實驗:
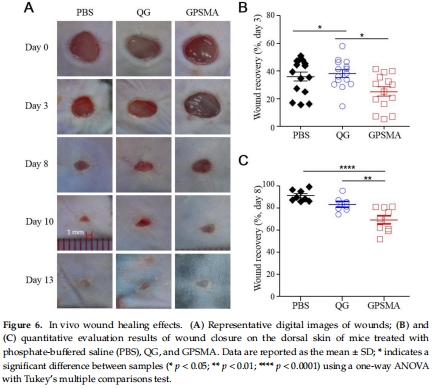
LPS感染小鼠傷口模型(圖6)。
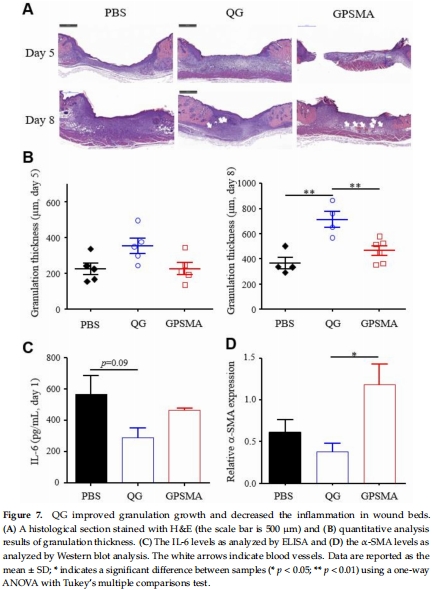
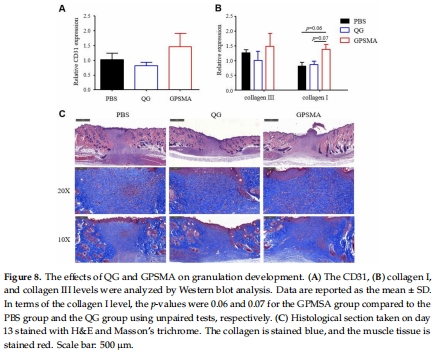
組織學分析(H&E、Masson染色,圖7-8)及血管生成標記(CD31,圖8A)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1) LPS清除能力(圖4A)
數(shù)據(jù):QG濃度依賴性地結(jié)合LPS(熒光強度隨QG增加而升高)。
意義:QG通過靜電作用捕獲LPS,阻斷TLR4/NF-κB炎癥通路(圖5C),縮短炎癥期。
(2) 催化供氧能力(圖4E)
數(shù)據(jù):
Unisense電極動態(tài)監(jiān)測:QG和GPSMA在30分鐘內(nèi)將H?O?分解為O?,O?濃度顯著高于對照組。
GPSMA的O?釋放速率低于游離QG,但持續(xù)時間更長。
意義:證實QG內(nèi)核的 類過氧化氫酶活性,為缺氧傷口提供原位供氧。
(3) 傷口愈合效果(圖6-8)
數(shù)據(jù):
傷口閉合率:液態(tài)QG在第3天顯著加速閉合(圖6B)。
組織學分析:GPSMA組血管生成(CD31↑,圖8A)和膠原沉積(膠原I/III↑,圖8B)更強。
炎癥抑制:QG組IL-6水平降低(圖7C)。
意義:QG通過 LPS清除+供氧 雙機制協(xié)同促進組織再生。
5. 結(jié)論
1.QG的雙功能協(xié)同:
外冠層(PAMAM)捕獲LPS,減輕炎癥;
內(nèi)核(金納米簇)催化H?O?分解供氧,逆轉(zhuǎn)組織缺氧。
2.應用形式優(yōu)勢:
液態(tài)QG:快速滲透,早期抑制炎癥(圖6);
GPSMA敷料:長效供氧,促進后期血管生成與膠原重塑(圖8)。
3.臨床潛力:為慢性傷口(如糖尿病潰瘍)提供免抗生素治療新策略。
6. 丹麥Unisense電極的核心價值
(1) 技術(shù)突破性應用
實時動態(tài)監(jiān)測O?生成:
采用 Unisense OXY-Meter微電極(方法4.3節(jié))實時記錄QG催化H?O?分解的O?釋放動力學(圖4E)。
關(guān)鍵數(shù)據(jù):QG在30分鐘內(nèi)使O?濃度從0升至>200 μM,GPSMA緩釋效果更持久。
(2) 關(guān)鍵科學貢獻
精準量化催化效率:
直接證實QG的 類過氧化氫酶活性,推翻“納米金催化活性受聚合物封裝抑制”的假設(圖4D-E)。
揭示材料設計優(yōu)勢:
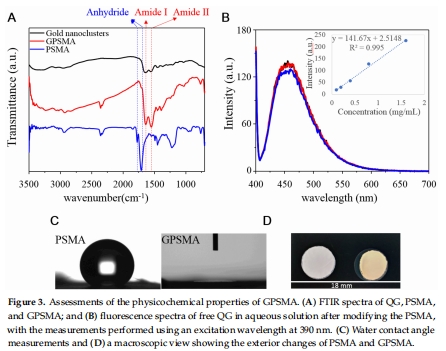
GPSMA的松散封裝結(jié)構(gòu)(圖3A)保持內(nèi)核催化活性,為納米酶設計提供新范式。
(3) 研究意義
機制深度解析:
Unisense數(shù)據(jù)將 材料催化活性 與 體內(nèi)血管生成(圖8A)直接關(guān)聯(lián),證實供氧是促愈關(guān)鍵。
技術(shù)不可替代性:
傳統(tǒng)氧電極無法實現(xiàn) 秒級響應(Unisense響應時間<10秒)和 微環(huán)境原位監(jiān)測(避免樣本轉(zhuǎn)移干擾)。
總結(jié)
本研究通過 Unisense電極的高精度氧監(jiān)測,首次證實量子化金(QG)可通過 LPS清除+催化供氧 雙機制協(xié)同促進傷口愈合。其技術(shù)價值在于:
1.催化動力學精準刻畫:Unisense揭示QG的溫和持續(xù)供氧特性(避免氧中毒),為臨床安全應用提供依據(jù);
2.材料設計驗證:證實松散封裝結(jié)構(gòu)(GPSMA)保持催化活性,解決納米酶封裝難題;
3.轉(zhuǎn)化醫(yī)學橋梁:動態(tài)氧數(shù)據(jù)為QG敷料的臨床劑量優(yōu)化(如GPSMA每2天更換)提供直接參數(shù)支持。
這一發(fā)現(xiàn)為慢性傷口治療提供了免抗生素的新策略,凸顯Unisense電極在生物材料評價中的不可替代性。