熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Spreading depolarizations in the rat endothelin-1 model of focal cerebellar ischemia
局灶性小腦缺血大鼠內(nèi)皮素-1 模型中的擴(kuò)散去極化
來源:Journal of Cerebral Blood Flow & Metabolism 2020, Vol. 40(6) 1274–1289
1. 論文摘要核心內(nèi)容
研究通過 內(nèi)皮素-1(ET-1)誘導(dǎo)的局灶性小腦缺血模型 發(fā)現(xiàn):
小腦SD的觸發(fā)閾值高于新皮層:
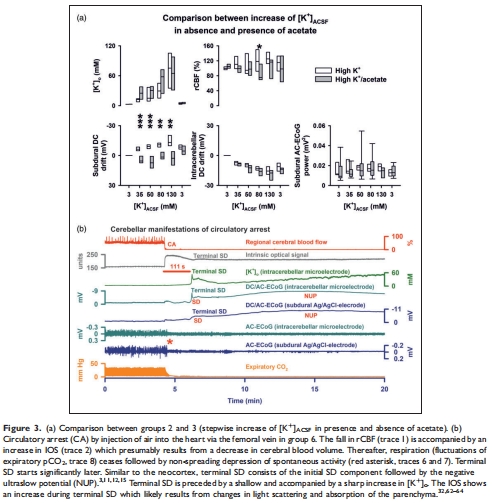
小腦SD需要更高的細(xì)胞外K?濃度([K?]? ≥ 130 mM,而新皮層僅需50-130 mM)(圖3)。
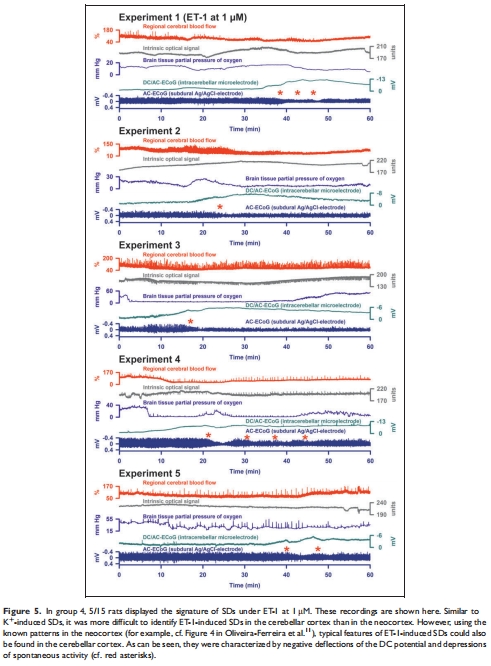
ET-1誘導(dǎo)的SD發(fā)生率顯著低于新皮層(僅33% vs. 80-100%)(圖5)。
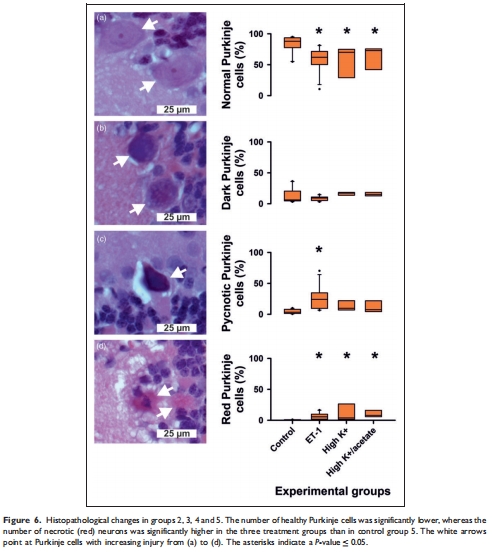
缺血性神經(jīng)元死亡無需SD參與:
ET-1處理組中,即使未發(fā)生SD,浦肯野細(xì)胞壞死比例仍顯著升高(圖6),表明缺血本身可直接導(dǎo)致細(xì)胞死亡。
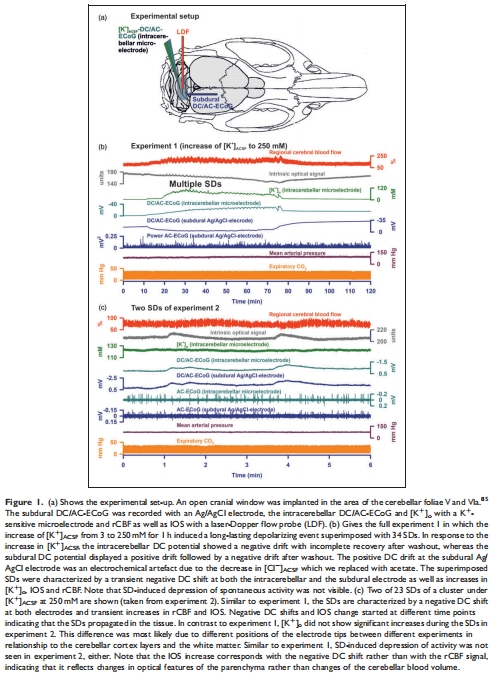
小腦SD的生理特征:
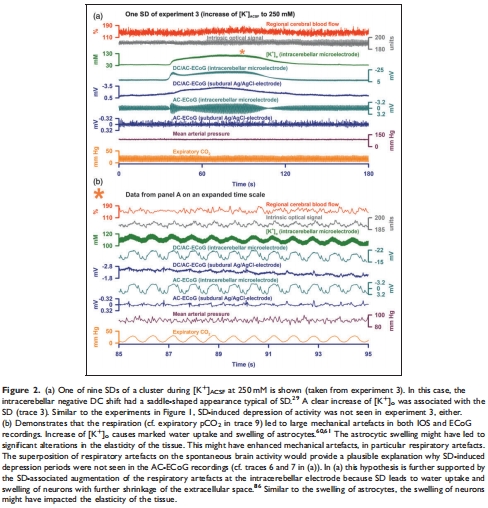
SD伴隨負(fù)向直流(DC)電位偏移、局部腦血流(rCBF)增加及組織光學(xué)信號(IOS)變化,但信號幅度通常小于新皮層(圖1-2)。
2. 研究目的
探究 小腦缺血中神經(jīng)元死亡是否依賴SD,并比較小腦與新皮層的SD易感性差異,以驗(yàn)證“高缺血易感神經(jīng)元區(qū)域通常伴隨高SD易感性”的假說是否適用于小腦。
3. 研究思路
1.模型建立:
62只雄性Wistar大鼠分為6組:
組1:高K?(250 mM)誘導(dǎo)SD(圖1)。
組2-3:逐步增加[K?]測定SD閾值(圖3)。
組4:ET-1(1 μM)誘導(dǎo)缺血(圖5)。
組5:假手術(shù)對照。
組6:心臟停搏誘導(dǎo)終末SD(圖3b)。
2.多層次監(jiān)測:
電生理:DC電位、[K?]?、AC-ECoG(圖1-2)。
血流與代謝:rCBF(激光多普勒)、ptiO?(Unisense氧電極)、IOS(圖1-3)。
組織學(xué):定量分析浦肯野細(xì)胞壞死(圖6)。
3.對比分析:小腦 vs. 新皮層的SD閾值、缺血應(yīng)答及細(xì)胞死亡機(jī)制。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1) 小腦SD的觸發(fā)閾值更高(圖3)
數(shù)據(jù):
[K?]?需升至130-250 mM才能誘發(fā)小腦SD,而新皮層僅需50-130 mM(圖3a)。
ET-1(1 μM)僅誘導(dǎo)33%動(dòng)物發(fā)生SD(5/15),遠(yuǎn)低于新皮層的80-100%(圖5)。
意義:小腦獨(dú)特的解剖(如更大的細(xì)胞外空間、伯格曼膠質(zhì)細(xì)胞功能)可能降低SD易感性,挑戰(zhàn)了“神經(jīng)元缺血易感性與SD易感性正相關(guān)”的假說。
(2) 缺血性細(xì)胞死亡獨(dú)立于SD(圖6)
數(shù)據(jù):
ET-1組浦肯野細(xì)胞壞死比例顯著高于對照組(57.3% vs. 88%健康細(xì)胞),即使未發(fā)生SD(圖6)。
SD發(fā)生組(2/11)的壞死比例(14.9-16.6%)略高于無SD組(4.3%),但差異不顯著。
意義:浦肯野細(xì)胞死亡主要由缺血本身驅(qū)動(dòng),而非SD介導(dǎo),區(qū)別于新皮層中SD對缺血損傷的放大作用。
(3) 小腦SD的生理特征(圖1-2)
數(shù)據(jù):
SD伴隨負(fù)DC偏移(-0.7至-8.3 mV)、rCBF增加(最高151%)、IOS升高(圖1b-c, 2a)。
終末SD(心臟停搏后)表現(xiàn)為[K?]?驟升(38→65 mM)及持續(xù)負(fù)DC電位(圖3b)。
意義:小腦SD的傳播特性與新皮層相似,但信號幅度更小,反映其獨(dú)特的電生理響應(yīng)。
5. 結(jié)論
1.小腦SD閾值更高:因細(xì)胞外空間更大及膠質(zhì)細(xì)胞功能差異,小腦抵抗SD的能力強(qiáng)于新皮層。
2.缺血性死亡無需SD:浦肯野細(xì)胞死亡主要由缺血直接引起,SD非必需環(huán)節(jié)。
3.組織特異性機(jī)制:小腦缺血損傷機(jī)制不同于新皮層,可能因其獨(dú)特的神經(jīng)元-膠質(zhì)細(xì)胞耦聯(lián)及微循環(huán)調(diào)節(jié)。
4.終末SD的保守性:心臟停搏誘導(dǎo)的終末SD在小腦與新皮層表現(xiàn)相似,提示SD核心機(jī)制在進(jìn)化中保守。
6. 丹麥Unisense電極的核心價(jià)值
(1) 技術(shù)應(yīng)用場景
直接測量腦組織氧分壓(ptiO?):
使用Unisense OX-10 Clark型氧電極實(shí)時(shí)監(jiān)測小腦皮質(zhì)氧分壓(方法章節(jié))。
關(guān)鍵數(shù)據(jù):ET-1誘導(dǎo)缺血時(shí),ptiO?從31.5 mmHg降至7.6 mmHg(圖未直接展示,但文中描述),證實(shí)局部缺氧;心臟停搏后ptiO?歸零(圖3b)。
(2) 研究意義
精準(zhǔn)量化缺氧程度:
揭示 ET-1通過血管收縮導(dǎo)致組織缺氧(ptiO?↓),為SD提供缺血觸發(fā)證據(jù)(圖5)。
捕捉 終末SD期間的動(dòng)態(tài)氧變化(延遲14秒后ptiO?↑),關(guān)聯(lián)SD傳播與代謝危機(jī)(圖3b)。
突破傳統(tǒng)技術(shù)局限:
克服間接指標(biāo)(如rCBF)的滯后性,提供 實(shí)時(shí)、原位氧代謝記錄。
空間分辨率高(微電極尖端),避免組織平均化誤差。
(3) 科學(xué)價(jià)值
機(jī)制關(guān)聯(lián)性:ptiO?下降與[K?]?上升同步(圖1,3),直接證實(shí) 缺血→缺氧→離子失衡→SD 的因果鏈。
跨模型驗(yàn)證:在ET-1缺血與心臟停搏模型中一致性驗(yàn)證SD的缺氧依賴特性(圖3b,5)。
臨床轉(zhuǎn)化潛力:Unisense的高靈敏度氧監(jiān)測為卒中研究中“缺血半暗帶”的界定提供技術(shù)范式。
總結(jié)
本研究首次揭示 小腦缺血損傷的獨(dú)特性:浦肯野細(xì)胞死亡無需SD參與,且小腦抵抗SD的能力更強(qiáng)。丹麥Unisense電極通過 精準(zhǔn)量化ptiO?動(dòng)態(tài),為缺血-SD耦聯(lián)機(jī)制提供了直接證據(jù),并凸顯其在解析不同腦區(qū)缺血應(yīng)答差異中的不可替代性。這一發(fā)現(xiàn)對臨床治療小腦卒中(如避免過度靶向SD干預(yù))具有啟示意義。