熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Mechanisms underlying the predictive power of high skeletal muscle uptake of FDG in amyotrophic lateral sclerosis
肌萎縮側索硬化癥中骨骼肌高攝取 FDG 的預測能力的潛在機制
來源:Marini et al. EJNMMI Research (2020) 10:76
1. 論文摘要核心內容
研究通過 SOD1G93A轉基因小鼠模型(模擬人類ALS)發現:
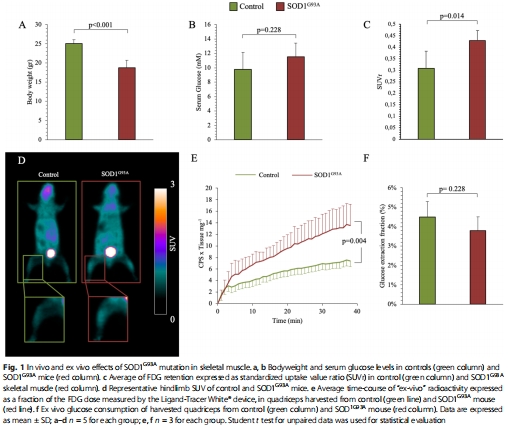
骨骼肌FDG攝取顯著升高(圖1c-d),與ALS患者臨床觀察一致。
機制與氧化應激直接相關:
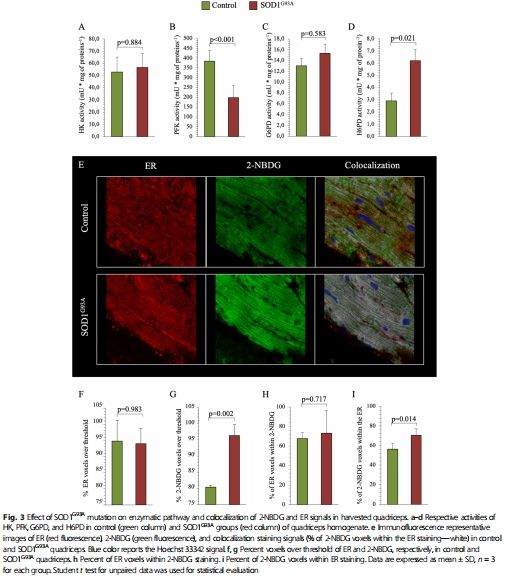
內質網(ER)中 H6PD酶活性增強(圖3d),激活內質網特異性磷酸戊糖途徑(ER-PPP),消耗葡萄糖生成NADPH以對抗活性氧(ROS)。
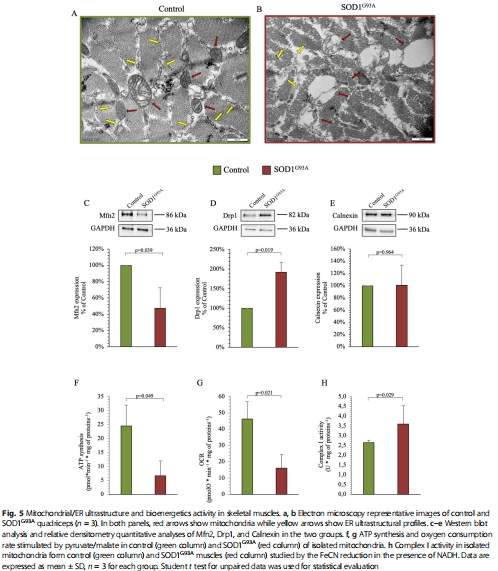
線粒體結構與功能嚴重受損(圖5a-b),導致 ATP合成減少(圖5f)和 氧消耗率(OCR)下降(圖5g)。
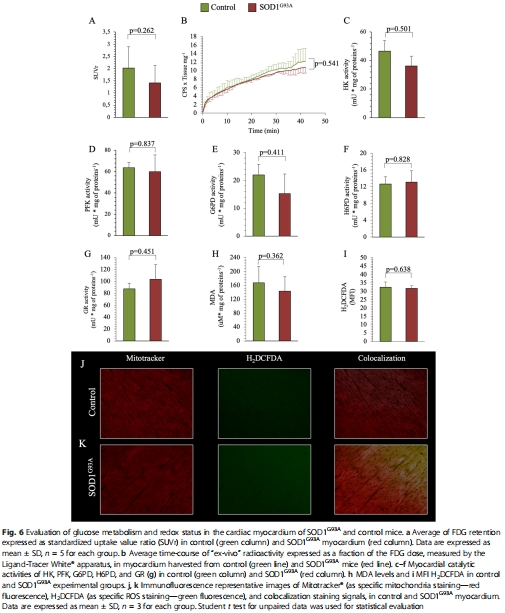
心肌受影響較輕:FDG攝取、氧化應激和線粒體損傷均顯著低于骨骼肌(圖6),提示病變與神經肌肉接頭或收縮模式相關。
2. 研究目的
探究 骨骼肌FDG高攝取的分子機制,驗證其是否反映 氧化應激 而非單純糖代謝加速,并闡明其在ALS疾病進展中的預測價值。
3. 研究思路
1.模型建立:
15只SOD1G93A轉基因小鼠(ALS模型)vs. 15只野生型對照(120日齡)。
2.多層次驗證:
影像學:micro-PET檢測骨骼肌FDG攝取(圖1c-d)。
生化分析:酶活性(HK、PFK、G6PD、H6PD)、氧化應激指標(MDA、NADPH/NADP?)、線粒體功能(圖3-6)。
細胞定位:2-NBDG(熒光FDG類似物)與ER共定位(圖3e-i)。
超微結構:電鏡觀察線粒體形態(圖5a-b)。
3.對比研究:骨骼肌 vs. 心肌(圖6),揭示組織特異性差異。
4. 關鍵數據及研究意義
(1) FDG攝取與葡萄糖代謝解耦(圖1 & 圖3)
數據:
SOD1G93A小鼠骨骼肌FDG攝取升高40%(SUVr: 0.43 vs. 0.31,圖1c),但 葡萄糖消耗未增加(圖1f)。
H6PD活性升高(ER-PPP關鍵酶),而糖酵解酶(HK、PFK)活性不變或降低(圖3a-d)。
意義:FDG高攝取反映 ER-PPP激活,而非經典糖酵解,推翻“FDG=糖代謝”傳統觀點。
(2) 氧化應激與線粒體損傷(圖4-5)
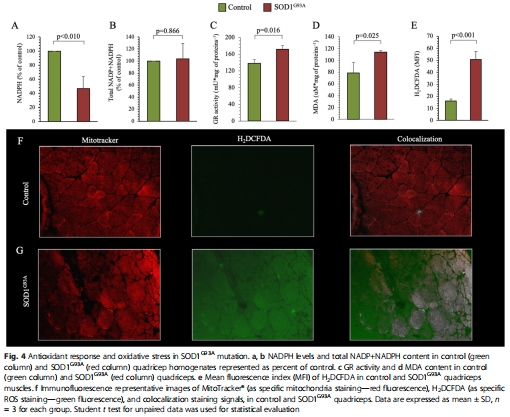
數據:
脂質過氧化:MDA水平升高(圖4d),ROS熒光信號增強(圖4f)。
線粒體結構破壞:嵴結構紊亂、數量減少(圖5b)。
融合/分裂失衡:Mfn2(融合蛋白)↓、Drp1(分裂蛋白)↑(圖5c-d)。
意義:證實 氧化應激-線粒體損傷-能量衰竭 惡性循環是ALS骨骼肌病變核心。
(3) 心肌相對保護(圖6)
數據:
心肌FDG攝取、H6PD活性、MDA水平均與對照組無差異(圖6a-h)。
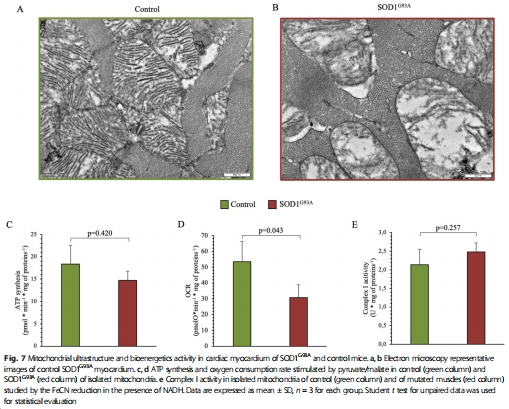
線粒體OCR僅輕微下降(圖6c),結構損傷較輕(圖7a-b)。
意義:病變具有 骨骼肌特異性,可能與神經支配或收縮模式差異相關。
5. 結論
1.FDG攝取機制:骨骼肌FDG高攝取反映 ER-PPP激活,是氧化應激的生物標志物,而非能量需求增加。
2.線粒體核心角色:線粒體-ER耦聯破壞導致ROS累積,觸發ER-PPP代償性增強,形成惡性循環。
3.組織特異性:病變主要累及神經支配的骨骼肌,心肌因自主節律收縮相對受保護。
4.臨床價值:FDG-PET可作為無創評估ALS骨骼肌氧化應激的工具,指導靶向抗氧化治療。
6. 丹麥Unisense電極的核心價值
(1) 技術應用場景
直接測量線粒體耗氧率(OCR):
使用Unisense微呼吸系統(Microrespiration)實時監測離體線粒體氧消耗(方法章節)。
關鍵數據:SOD1G93A骨骼肌線粒體OCR顯著降低(圖5g),而心肌僅輕微下降(圖7c)。
(2) 研究意義
精準量化能量代謝缺陷:
直接證明 ATP合成障礙(圖5f)源于 電子傳遞鏈功能障礙(非底物不足),排除糖代謝干擾。
揭示 組織差異機制:骨骼肌OCR下降(>50%)遠高于心肌(<20%),解釋病變選擇性。
突破傳統檢測局限:
克服間接指標(如HIF-1α)的滯后性,實現 動態、實時監測氧代謝。
提供 空間分辨率:通過離體線粒體分離,排除細胞質信號干擾。
(3) 科學價值
機制關聯性:OCR下降與線粒體超微結構損傷(嵴破壞)直接對應(圖5b,g),為“結構-功能”理論提供實證。
轉化潛力:Unisense的高靈敏度氧監測可拓展至臨床線粒體病診斷,如ALS患者肌肉活檢的離體驗證。
總結
本研究揭示ALS骨骼肌FDG高攝取的本質是 ER-PPP激活對抗氧化應激,丹麥Unisense電極通過 精準量化線粒體OCR,確證了能量衰竭與結構損傷的因果關系。這一技術不僅深化了對ALS病理機制的理解,更為開發靶向線粒體的治療策略(如改善線粒體-ER耦聯)提供了直接的功能學評估工具。