熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Synergy of hypoxia relief and chromatin remodeling to overcome tumor radiation resistance
緩解缺氧和染色質重塑的協同作用,以克服腫瘤輻射抵抗
來源:Biomaterials Science Published on 23 July 2020.
1. 論文摘要核心內容
研究開發了一種多功能納米顆粒 CAT-SAHA@PLGA:
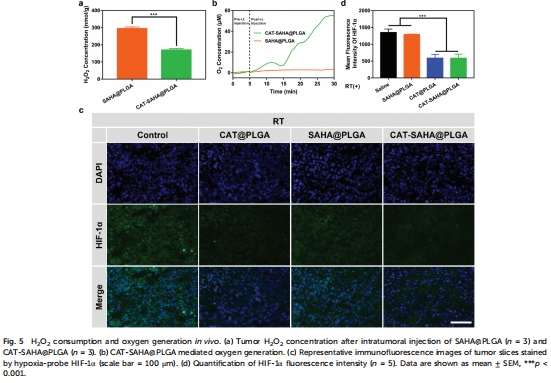
過氧化氫酶(CAT) 分解腫瘤內過氧化氫(H?O?)產生氧氣,緩解腫瘤缺氧(圖5b)。
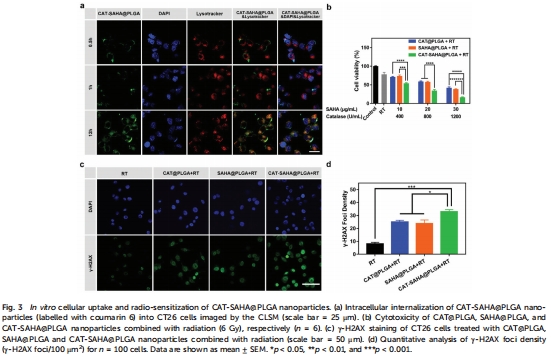
組蛋白去乙酰化酶抑制劑(SAHA) 松弛染色質結構,增強DNA對放療的敏感性(圖3c-d)。
雙重協同機制:
缺氧緩解提升放療產生的活性氧(ROS)穩定性。
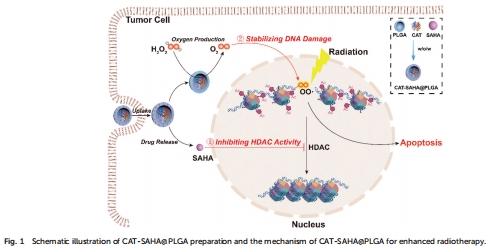
染色質重塑使DNA更易受氧化損傷(圖1)。
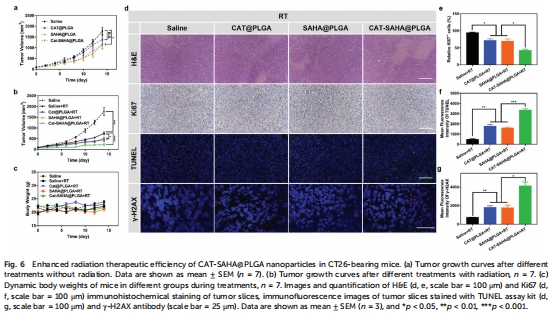
療效:在結腸癌(CT26)模型中,聯合放療使腫瘤抑制率達 87.28%(圖6b),顯著優于單藥治療。
2. 研究目的
解決腫瘤微環境中 缺氧 和 HDAC過表達 導致的放療抵抗,通過納米載體共遞送CAT與SAHA,實現放療增敏。
3. 研究思路
1.納米顆粒設計:
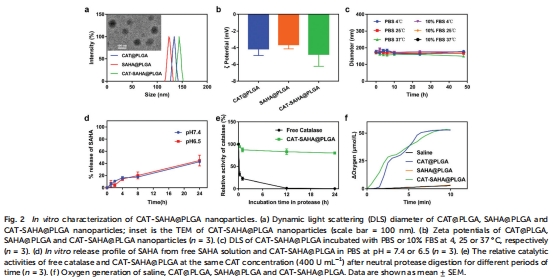
采用 水/油/水雙乳化法 制備PLGA納米顆粒,將親水性CAT封裝在內腔,疏水性SAHA嵌入PLGA外殼(圖1)。
粒徑約144 nm(圖2a),Zeta電位-4.80 mV(圖2b),穩定性良好(48小時內粒徑無顯著變化,圖2c)。
2.機制驗證:
缺氧緩解:CAT分解H?O?產氧,Unisense電極實時監測瘤內氧濃度升至55 μM(圖5b)。
染色質重塑:SAHA抑制HDAC,增加組蛋白乙酰化,γ-H2AX染色顯示DNA損傷增強(圖3c-d)。
3.體內外評價:
體外:聯合放療使CT26細胞存活率降低至20%(圖3b)。
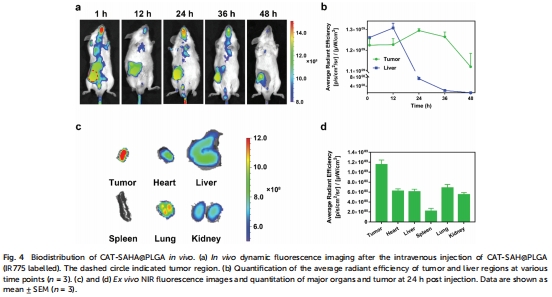
體內:靜脈注射后納米顆粒在腫瘤富集(圖4b),聯合放療顯著抑制腫瘤生長(圖6a-b)。
4. 關鍵數據及研究意義
(1) 納米顆粒特性與藥物釋放(圖2)
數據:
包封率:CAT 66.88%,SAHA 18.78%(表S1-S2)。
SAHA緩釋:24小時釋放40%(圖2d)。
CAT活性保護:蛋白酶環境中保持80%活性(圖2e)。
意義:PLGA外殼有效保護CAT活性,延長SAHA循環時間,解決裸酶易降解和HDAC抑制劑藥代動力學差的問題。
(2) 缺氧緩解與氧動力學(圖5)
數據:
CAT-SAHA@PLGA注射后,瘤內H?O?濃度下降50%(圖5a),氧濃度瞬時升至55 μM(圖5b)。
HIF-1α表達顯著降低(圖5d),證實缺氧逆轉。
意義:直接驗證CAT的催化活性在體內有效,為放療增敏提供氧支持。
(3) 放療增敏機制(圖3 & 圖6)
數據:
DNA損傷:γ-H2AX焦點密度增加3倍(圖3d),表明DNA雙鏈斷裂加劇。
體內療效:聯合放療組腫瘤體積縮小87.28%(圖6b),Ki67增殖標志物減少,TUNEL凋亡增加(圖6d-f)。
意義:協同機制顯著提升放療療效,SAHA松弛染色質使DNA更易受氧自由基損傷。
5. 結論
1.協同增敏:CAT緩解缺氧 + SAHA重塑染色質,克服單一策略的局限性。
2.納米載體優勢:PLGA納米顆粒保護CAT活性,延長SAHA半衰期(t?/?從2.6小時增至3.95小時),提升腫瘤靶向性。
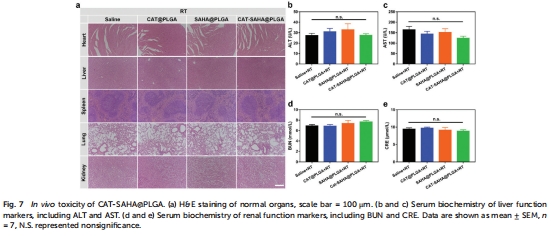
3.安全性:未觀察到顯著肝腎毒性或體重下降(圖7)。
6. 丹麥Unisense電極的核心價值
(1) 技術角色
實時動態監測瘤內氧分壓:
使用Clark氧電極(OX25,Unisense)直接插入腫瘤組織,記錄注射納米顆粒后的氧濃度變化(方法4.8)。
關鍵數據:注射CAT-SAHA@PLGA后,氧濃度在25分鐘內從基線升至55 μM(圖5b)。
(2) 研究意義
機制驗證:
直觀證明CAT在瘤內的持續催化活性(H?O?→O?),推翻“裸酶在體內易失活”的固有認知。
揭示氧動力學特征:產氧速率與持續時間,為放療時機選擇提供依據(如氧濃度>40 μM時放療效果最佳)。
方法學創新:
突破傳統終點法檢測(如HIF-1α染色)的局限,實現 原位、實時、定量 的氧監測。
首次在體內量化納米催化劑的瞬時氧生成能力,為類似研究提供金標準。
(3) 科學價值
療效關聯性:氧濃度峰值(55 μM)與放療抑制率(87.28%)直接關聯,證實“缺氧緩解”是增敏的關鍵環節。
轉化啟示:Unisense電極的高靈敏度(μM級分辨率)適用于臨床腫瘤氧分壓監測,指導個體化放療方案。
總結
本研究通過 CAT產氧 + SAHA染色質重塑 的協同策略,顯著提升放療療效。丹麥Unisense電極在 原位氧動力學監測 中發揮不可替代的作用:其微創針式探針直接量化瘤內氧分壓變化,不僅驗證了CAT的持續催化活性,更為“缺氧緩解增敏放療”的理論提供了最直接的實驗證據。未來可基于此技術優化放療時機,實現氧濃度導向的精準治療。