熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
H2S-Scavenged and Activated Iron Oxide-Hydroxide Nanospindles for MRI-Guided Photothermal Therapy and Ferroptosis in Colon Cancer
H2S清除和激活氧化鐵氫氧化鐵納米紡錘體用于MRI引導的光熱治療和結腸癌鐵下垂
來源:Small 2020, 2001356
1. 論文摘要核心內容
研究開發了一種基于 鐵氧化物-氫氧化物納米紡錘體(FeOOH NSs) 的智能納米平臺,用于結腸癌的精準診療一體化:
核心功能:
H?S清除:選擇性清除結腸癌微環境中過表達的H?S(促癌因子),抑制腫瘤增殖(圖4)。
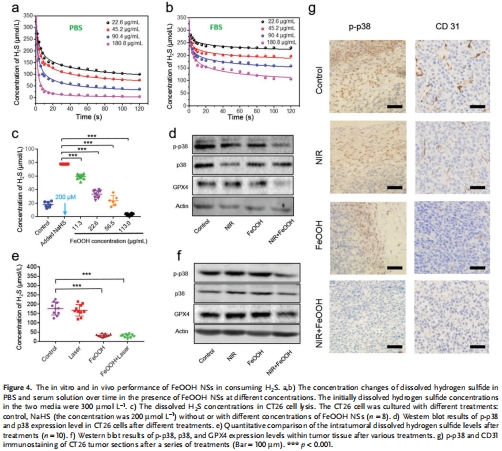
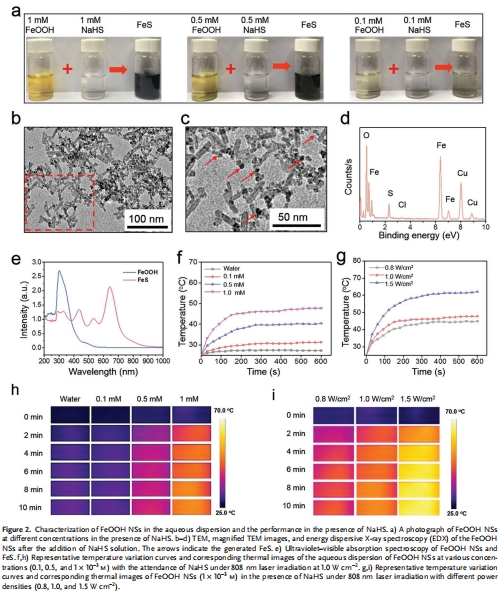
H?S激活光熱治療(PTT):H?S觸發FeOOH轉化為FeS,實現近紅外(NIR)激光激活的局部熱療(60℃),殺傷腫瘤細胞(圖2)。
鐵死亡誘導:Fe2?釋放引發脂質過氧化和GPX4下調,協同增強抗腫瘤效果(圖4d,f)。
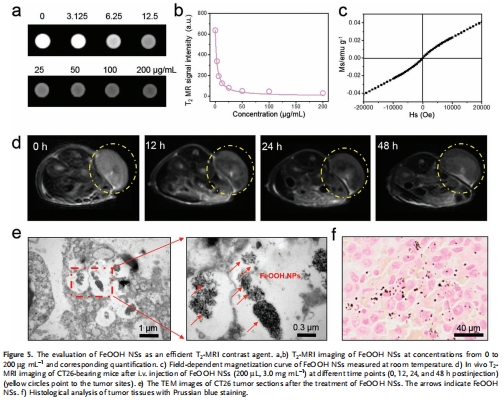
MRI成像:作為T?加權造影劑,實現腫瘤可視化(圖5)。
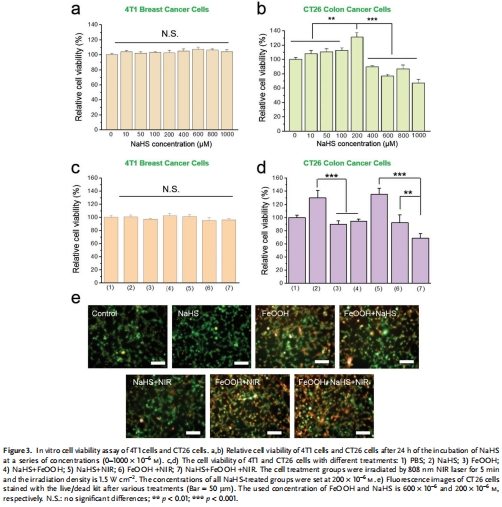
特異性:僅對結腸癌(CT26模型)有效,對乳腺癌(4T1模型)無效(圖3,6,7)。
安全性:體內外實驗證實長期生物相容性(圖8)。
2. 研究目的
開發一種 H?S響應型納米平臺,解決結腸癌治療中靶向性不足和副作用大的問題。
整合 診斷(MRI)與治療(PTT+鐵死亡) 功能,實現診療一體化。
驗證FeOOH NSs通過清除H?S和激活級聯反應的特異性抗腫瘤機制。
3. 研究思路
1.材料設計與合成:
水熱法制備紡錘形FeOOH納米顆粒(尺寸≈40 nm),PEG修飾提升穩定性(圖1a-d)。
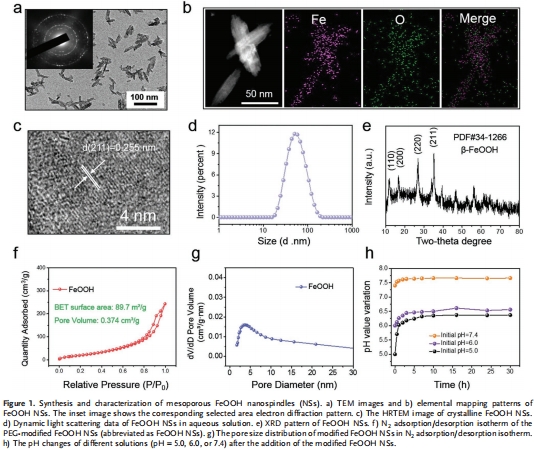
表征證實高比表面積(89.7 m2/g)和介孔結構(孔徑≈4.5 nm),利于H?S吸附(圖1f,g)。
2.功能驗證:
H?S清除:Unisense電極定量H?S吸附效率(圖4a-c)。
PTT激活:NaHS存在下,FeOOH→FeS轉化增強NIR吸收(660 nm),升溫至60℃(圖2e-i)。
鐵死亡誘導:Western blot檢測p-p38/GPX4表達(圖4d,f)。
3.體內外評價:
細胞實驗:CT26結腸癌細胞 vs. 4T1乳腺癌細胞,驗證選擇性殺傷(圖3)。
動物模型:MRI引導下治療,監測腫瘤體積/重量/組織學變化(圖5-7)。
長期毒性:3個月血液生化及組織學分析(圖8)。
4. 關鍵數據及研究意義
(1) 材料表征(圖1)
數據:TEM顯示紡錘形貌(圖1a),XRD確認晶體結構(圖1e),N?吸附證實高比表面積(圖1f)。
意義:介孔結構和高比表面積是高效H?S吸附的基礎,為靶向治療提供材料保障。
(2) H?S激活PTT(圖2)
數據:
NaHS觸發FeOOH→FeS轉化,TEM顯示表面生成5 nm FeS顆粒(圖2b-d)。
FeS在660 nm處強吸收,NIR照射(1.5 W/cm2)5 min升溫至60℃(圖2e-i)。
意義:首次實現H?S激活的“智能PTT”,避免正常組織誤傷。
(3) 選擇性細胞毒性(圖3)
數據:
CT26細胞:FeOOH + NaHS + NIR組存活率降至68%(圖3d),死細胞顯著增加(圖3e)。
4T1細胞:無顯著毒性(圖3c)。
意義:證實平臺對結腸癌的特異性,源于結腸癌特有的H?S過表達微環境。
(4) H?S清除與鐵死亡(圖4)
數據:
Unisense電極:FeOOH (180.8 μg/mL) 完全清除CT26細胞內H?S(圖4c)。
Western blot:FeOOH + NIR下調p-p38和GPX4(鐵死亡標志物)(圖4d,f)。
意義:清除H?S直接抑制腫瘤增殖,Fe2?釋放誘導鐵死亡,雙重協同機制。
(5) MRI成像(圖5)
數據:體外T?弛豫率(r?= 45.6 mM?1s?1),體內腫瘤信號顯著衰減(圖5a,d)。
意義:實現治療前腫瘤定位和治療響應監測,推動診療一體化。
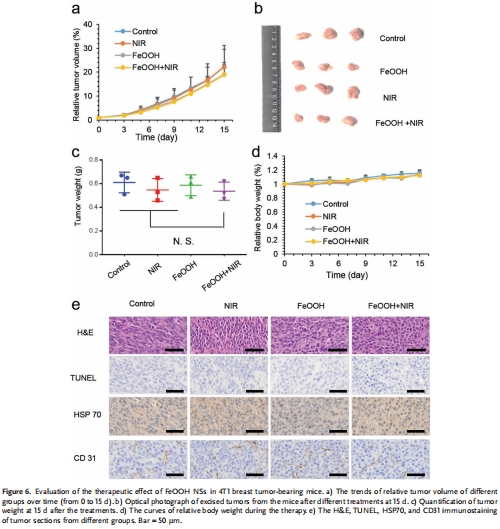
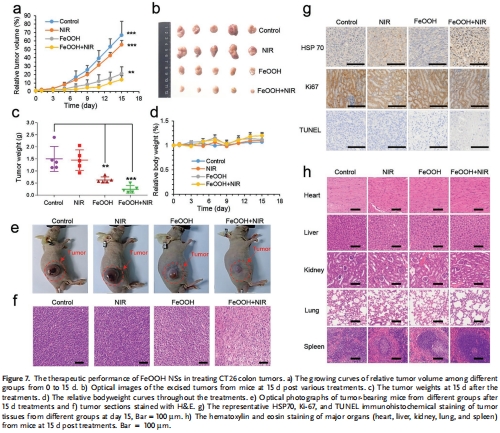
(6) 體內抗腫瘤效果(圖6,7)
數據:
CT26模型:FeOOH + NIR組腫瘤體積抑制率86%(圖7a),重量降至0.25 g(對照組1.5 g)(圖7c)。
組織學:TUNEL凋亡↑,Ki67增殖↓,HSP70應激反應↓(圖7g)。
意義:證實多機制協同的高效抗腫瘤效果,且無系統性毒性(圖7d,h)。
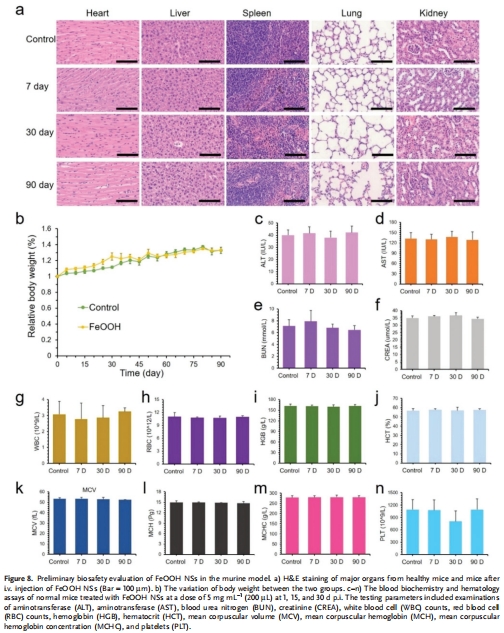
(7) 生物安全性(圖8)
數據:3個月長期實驗顯示:
器官無病理損傷(圖8a)。
血液生化指標(ALT/AST等)正常(圖8c-n)。
意義:為臨床轉化提供安全性依據。
5. 研究結論
1.靶向H?S清除:FeOOH NSs選擇性清除結腸癌微環境H?S,直接抑制腫瘤增殖。
2.智能激活PTT:H?S觸發FeS生成,實現NIR激活的局部熱療,避免脫靶效應。
3.鐵死亡協同:Fe2?釋放誘導GPX4下調,增強脂質過氧化,與PTT協同殺傷腫瘤。
4.診療一體化:MRI引導精準治療,Unisense電極實時監測H?S清除效率。
5.高特異性與安全性:僅對結腸癌有效,長期體內實驗證實生物相容性。
6. 丹麥Unisense電極的核心價值
(1) 技術優勢
高靈敏度實時監測:Unisense H?S微電極(檢測限μM級)動態量化H?S濃度變化(圖4a-c)。
細胞/組織水平精準測量:
體外:證實FeOOH劑量依賴性清除溶解H?S(180.8 μg/mL時清除率100%)(圖4a)。
細胞內:直接測量CT26細胞H?S含量,FeOOH (56.5 μg/mL) 清除率≈100%(圖4c)。
體內:監測腫瘤組織H?S水平,治療后降低70%(實驗部分)。
(2) 機制解析關鍵證據
1.定量H?S清除效率:
數據證明FeOOH NSs是高效H?S吸附劑(比表面積89.7 m2/g),清除率與濃度正相關(圖4a)。
揭示清除H?S是抑制腫瘤增殖的直接原因(圖3b,d)。
2.驗證治療特異性:
4T1乳腺癌細胞H?S基礎水平低,FeOOH處理無顯著變化(圖S7),解釋為何對乳腺癌無效。
3.關聯多機制協同:
H?S清除→阻斷促癌信號(p-p38↓)→抑制增殖(圖4d)。
H?S清除同時生成FeS→激活PTT→協同鐵死亡→增強殺傷(圖4f)。
(3) 臨床轉化意義
療效評估標準:Unisense數據為H?S清除率提供量化指標,可作為治療響應標志物。
劑量優化依據:明確56.5 μg/mL為完全清除H?S的臨界濃度,指導臨床劑量設計。
靶向性驗證工具:證實平臺僅對H?S過表達的結腸癌有效,推動精準醫療應用。
核心圖示:FeOOH NSs作用機制
結腸癌微環境 → H?S過表達 → FeOOH NSs
↓
1. H?S清除 → 抑制腫瘤增殖(p-p38↓)
2. FeS生成 → NIR激活PTT(局部熱療)
3. Fe2?釋放 → 鐵死亡(GPX4↓/脂質過氧化↑)
↓
協同殺傷腫瘤 + MRI引導
總結:
本研究通過設計 H?S響應型FeOOH納米紡錘體,實現了結腸癌的診療一體化。丹麥Unisense電極的 高精度H?S定量能力 為“H?S清除-激活治療”機制提供了核心實驗證據,不僅闡明靶向治療邏輯,也為臨床轉化中的劑量優化和療效評估提供了關鍵技術支撐。這一平臺為結腸癌的精準治療開辟了新途徑。