熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
CeO2 Nanoparticles Regulate the Propagation of Antibiotic Resistance Genes by Altering Cellular Contact and Plasmid Transfer
CeO2納米顆粒通過改變細胞接觸和質粒轉移來調節抗生素抗性基因的傳播
來源:Environmental Science & Technology 2020 54 (16), 10012-10021
1. 論文摘要核心內容
研究揭示 CeO?納米顆粒(NPs)通過調控細菌細胞接觸和質粒轉移影響ARGs水平傳播:
核心發現:
低濃度CeO? NPs(1–5 mg/L):抑制ARGs接合轉移(降低24–25%),機制包括清除ROS、減少胞外聚合物(EPS)合成、降低細胞粘附力、抑制能量代謝(圖2a, 圖4c)。
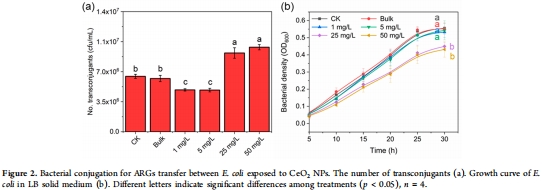
高濃度CeO? NPs(25–50 mg/L):促進ARGs轉移(增加42–53%),機制涉及誘導氧化應激、激活SOS響應、增加EPS合成、提升ATP供應(圖2a, 圖3a, 圖5b)。
技術亮點:首次結合土壤模型(自然/無菌土壤)和LB平板系統,通過多組學分析(轉錄組、代謝組)闡明CeO? NPs的雙向劑量效應。
環境意義:為農業納米技術安全應用提供劑量指導(推薦≤5 mg/kg),抑制ARGs環境傳播。
2. 研究目的
探究CeO? NPs(農業納米技術常用材料)對土壤中ARGs水平轉移(HGT)的影響。
揭示NPs劑量依賴性效應的分子機制(氧化應激、細胞粘附、能量代謝)。
評估納米顆粒在真實土壤環境中的生態風險,提出安全應用閾值。
3. 研究思路
1.多尺度模型設計:
自然土壤:豬場土壤暴露于CeO? NPs(0, 5, 50 mg/kg),檢測ARGs豐度變化(圖1a)。
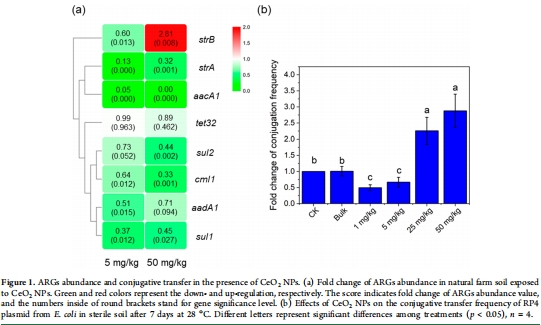
無菌土壤:接種大腸桿菌(含RP4質粒),測定接合轉移頻率(圖1b)。
LB平板模型:精確控制NPs濃度(0–50 mg/L),量化接合轉移、ROS、EPS、ATP等(圖2–6)。
2.機制驗證:
氧化應激:流式細胞術測ROS,酶活檢測(SOD/CAT),轉錄組分析SOS響應基因(圖3)。
細胞粘附:EPS含量測定(多糖/蛋白),細菌粘附實驗,基因表達分析(圖4)。
能量代謝:Unisense電極測呼吸速率,ATP含量檢測,電子傳遞鏈(ETC)基因表達(圖5)。
3.環境關聯:對比實驗室模型與真實土壤結果,評估生態風險。
4. 關鍵數據及研究意義
(1) ARGs豐度與接合轉移(圖1, 圖2)
數據:
自然土壤:50 mg/kg CeO? NPs降低多數ARGs豐度(如aacA1↓),但strB顯著↑(圖1a)。
無菌土壤/LB平板:低濃度NPs(1–5 mg/L)抑制接合轉移頻率↓24–25%,高濃度(25–50 mg/L)促進↑42–53%(圖1b, 圖2a)。
意義:首次發現CeO? NPs對ARGs傳播的雙向劑量效應,挑戰“NPs單向促進ARGs”的傳統認知。
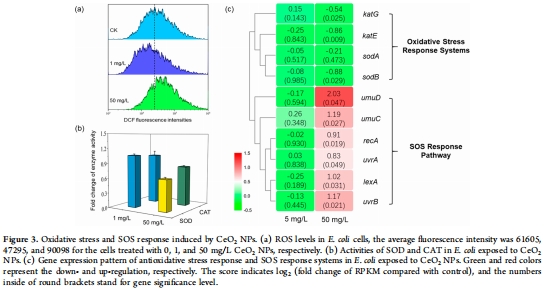
(2) 氧化應激與SOS響應(圖3)
數據:
高濃度CeO? NPs(50 mg/L):ROS↑90%,SOD/CAT活性↓,SOS基因(lexA/recA)↑2倍(圖3a–c)。
低濃度(1 mg/L):ROS↓,抗氧化酶無變化(圖3a)。
意義:闡明NPs通過ROS-SOS軸調控質粒轉移,高濃度激活DNA修復機制促進HGT。
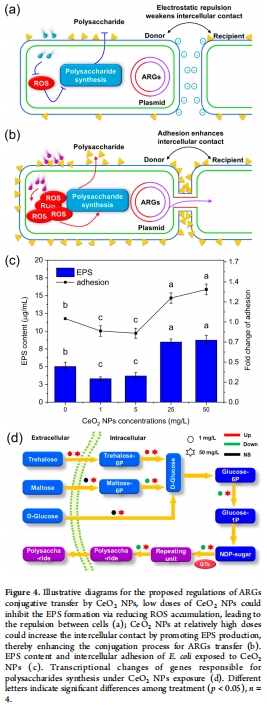
(3) 細胞粘附與EPS調控(圖4)
數據:
低濃度NPs:EPS多糖↓33–42%,細胞粘附力↓15–17%(圖4c)。
高濃度NPs:EPS多糖↑86–89%,粘附力↑(圖4c);多糖合成基因(如GTs)顯著上調(圖4d)。
意義:EPS是細胞接觸的關鍵介質,其劑量依賴性變化直接決定接合轉移效率。
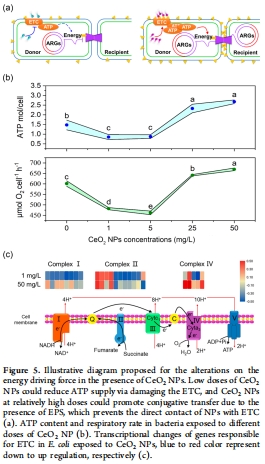
(4) 能量代謝與ATP驅動(圖5)
數據:
低濃度:呼吸速率↓20%,ATP↓57–59%,ETC基因(nuo系列)下調(圖5b–c)。
高濃度:呼吸速率↑13%,ATP↑158–181%,ETC復合體II/IV基因(frdA/cydB)上調(圖5b–c)。
意義:能量供應是接合轉移的限速步驟,ATP水平與轉移頻率正相關。
(5) 質粒轉移基因表達(圖6)
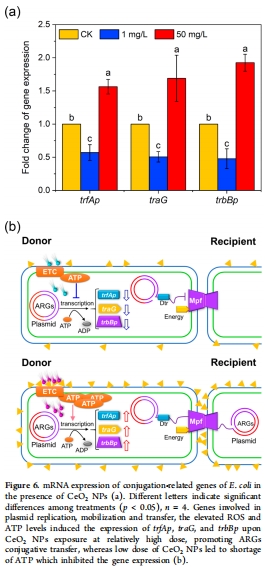
數據:
高濃度NPs:接合相關基因(trbBp, trfAp, traG)顯著上調(圖6a)。
低濃度:基因表達受抑(圖6a)。
意義:NPs通過調控質粒編碼的轉移裝置基因(Mpf/Dtr)直接影響ARGs傳播。
5. 研究結論
1.雙向劑量效應:
低劑量CeO? NPs(≤5 mg/kg):抑制ARGs傳播,機制為清除ROS→減少EPS→降低細胞接觸→抑制能量合成。
高劑量(≥25 mg/kg):促進ARGs傳播,機制為誘導ROS→激活SOS→增加EPS→提升ATP供應。
2.納米特異性:CeO? NPs效應顯著強于塊體顆粒(BPs),證實“尺寸效應”(圖2a)。
3.環境推薦:農業應用CeO? NPs時應控制濃度≤5 mg/kg,以兼顧植物促生與ARGs抑制。
4.機制框架:建立“氧化應激–細胞粘附–能量代謝”三聯調控模型(圖4, 圖5, 圖6b)。
6. 丹麥Unisense電極的核心價值
(1) 技術優勢
高精度實時監測:Unisense微呼吸系統(電極尖端500 μm)直接測定細菌呼吸速率(圖5b),靈敏度達單細胞水平。
動態能量代謝解析:同步關聯呼吸速率與ATP含量,揭示CeO? NPs對電子傳遞鏈(ETC)的劑量效應:
低濃度抑制ETC(復合體I/II基因下調)→ 呼吸↓ → ATP↓ → 接合轉移受限。
高濃度激活替代ETC路徑(復合體II/IV基因上調)→ 呼吸↑ → ATP↑ → 接合轉移增強。
(2) 科學突破
1.揭示能量代謝的核心地位:
Unisense數據首次證實:ATP水平是接合轉移的限速因子(圖5b)。
低濃度NPs通過抑制ETC減少ATP合成,直接限制質粒轉移的能量需求(圖5c)。
2.解析納米-生物界面相互作用:
呼吸速率變化反映NPs對ETC的直接影響:
低濃度:NPs穿透細胞膜→ 破壞ETC復合體→ 電子泄漏↓ → 呼吸抑制。
高濃度:EPS屏障形成→ 減少NPs接觸→ ETC代償性增強→ 呼吸促進。
(3) 環境應用意義
劑量閾值確定:Unisense數據支撐“5 mg/kg”安全閾值,低于此濃度時呼吸抑制→能量受限→ARGs傳播受阻。
納米毒性預警:呼吸速率可作為NPs生態風險的敏感指標,早于傳統毒性終點(如生長抑制)。
精準調控策略:通過設計NPs表面修飾(如增強ROS清除能力),優化低劑量抑菌增效應。
核心圖示:CeO? NPs的雙向調控機制
低濃度CeO? NPs → 清除ROS → EPS↓ → 細胞接觸↓ + ETC抑制→ATP↓ → 抑制接合轉移
↓
高濃度CeO? NPs → 誘導ROS → EPS↑ → 細胞接觸↑ + ETC激活→ATP↑ → 促進接合轉移
總結:
本研究通過整合 土壤-平板-分子 多模型,揭示CeO? NPs對ARGs傳播的雙向劑量效應。丹麥Unisense電極的 高分辨率呼吸監測 為“能量代謝核心調控”理論提供關鍵技術支撐,不僅闡明NPs的生態風險機制,也為農業納米技術的安全設計提供理論依據。