熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Aβ initiates brain hypometabolism and network dysfunction via NOX2 activation: a potential onset mechanism of Alzheimer’s disease
Aβ 誘導(dǎo)急性氧化應(yīng)激,導(dǎo)致阿爾茨海默病發(fā)病機(jī)制中的腦葡萄糖代謝減退和多動癥
來源:biorxiv 2020.08.12.248492v4;Communications Biology volume 4, Article number: 1054 (2021)
1. 論文摘要核心內(nèi)容
研究揭示β-淀粉樣蛋白(Aβ????)通過激活NADPH氧化酶2(NOX2)誘發(fā)腦葡萄糖低代謝和神經(jīng)網(wǎng)絡(luò)功能障礙的機(jī)制:
核心發(fā)現(xiàn):
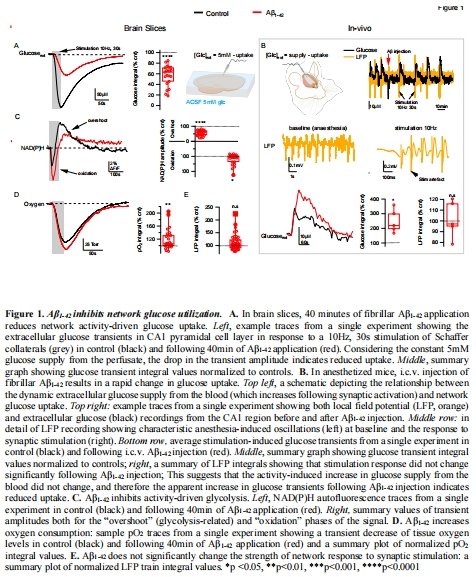
Aβ????激活NOX2 → 誘發(fā)氧化應(yīng)激 → 抑制糖酵解 → 導(dǎo)致腦葡萄糖利用率下降(圖1)。
葡萄糖低代謝進(jìn)一步引發(fā)海馬網(wǎng)絡(luò)超興奮(圖3)、病理性高頻振蕩(pHFOs)及焦慮/攻擊行為(圖4)。

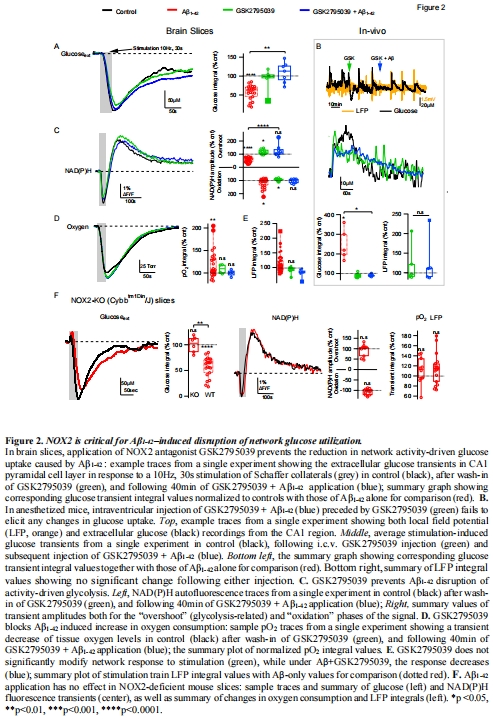
NOX2抑制劑GSK2795039可完全阻斷上述病理改變(圖2-4)。
意義:首次明確NOX2是連接Aβ毒性、腦低代謝與神經(jīng)功能障礙的關(guān)鍵節(jié)點(diǎn),為阿爾茨海默病(AD)早期干預(yù)提供新靶點(diǎn)。
2. 研究目的
闡明AD早期葡萄糖低代謝的分子機(jī)制(Aβ是否通過NOX2誘發(fā)氧化應(yīng)激)。
驗(yàn)證NOX2激活如何導(dǎo)致神經(jīng)網(wǎng)絡(luò)異常(超興奮、癲癇樣活動)。
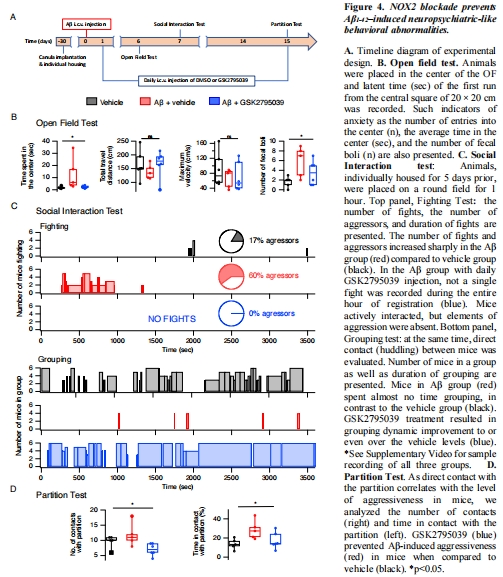
探究NOX2抑制劑能否逆轉(zhuǎn)Aβ誘導(dǎo)的行為學(xué)異常(焦慮、攻擊性)。
3. 研究思路
1.模型建立:
離體實(shí)驗(yàn):小鼠海馬腦片施加Aβ????(400 nM),模擬AD病理環(huán)境(圖1)。
在體實(shí)驗(yàn):清醒/麻醉小鼠腦室內(nèi)(i.c.v.)注射Aβ????(圖1B, 圖3)。
2.干預(yù)設(shè)計(jì):
NOX2抑制劑GSK2795039預(yù)處理(圖2)。
NOX2基因敲除小鼠(Cybb<sup>tm1din/J</sup>)驗(yàn)證(圖2F)。
3.多維度檢測:
代謝指標(biāo):葡萄糖/乳酸攝取、NAD(P)H/FAD熒光(糖酵解)、氧耗(圖1)。
電生理:局部場電位(LFP)、病理性高頻振蕩(pHFOs)(圖3)。
行為學(xué):曠場實(shí)驗(yàn)(焦慮)、社交互動測試(攻擊性)(圖4)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1) Aβ誘發(fā)葡萄糖低代謝(圖1)
數(shù)據(jù):
Aβ????使腦片葡萄糖攝取↓57.7%(圖1A)、在體葡萄糖瞬態(tài)振幅↑2倍(反映攝取↓)(圖1B)。
NAD(P)H"超射"(糖酵解標(biāo)志)↓ + "氧化相"↑(圖1C),氧耗↑(圖1D)。
意義:Aβ通過抑制糖酵解(非葡萄糖轉(zhuǎn)運(yùn))引發(fā)能量危機(jī),線粒體代償性耗氧增加。
(2) NOX2的核心作用(圖2)
數(shù)據(jù):
GSK2795039或NOX2基因敲除完全阻斷Aβ的代謝抑制(圖2A-F)。
Aβ升高脂質(zhì)過氧化標(biāo)志MDA(表1),GSK2795039逆轉(zhuǎn)此效應(yīng)。
意義:NOX2介導(dǎo)的氧化應(yīng)激是Aβ毒性的直接原因。
(3) 網(wǎng)絡(luò)功能障礙(圖3)
數(shù)據(jù):
Aβ注射后1小時(shí):LFP累積活動↑60.8%(圖3C),癲癇樣放電率↑325%(表1)。
48小時(shí)后:pHFOs(250-600 Hz)↑304%(圖3D)。
GSK2795039預(yù)防所有異常(圖3B-D)。
意義:代謝障礙→神經(jīng)網(wǎng)絡(luò)超興奮→癲癇樣活動,NOX2是核心驅(qū)動因子。
(4) 行為學(xué)異常(圖4)
數(shù)據(jù):
曠場實(shí)驗(yàn):Aβ組中央停留時(shí)間↑2倍(焦慮)、排便量↑(圖4B)。
社交測試:攻擊行為↑(打斗次數(shù)/持續(xù)時(shí)間↑)、群體親和行為↓(圖4C)。
隔板測試:接觸隔板時(shí)間↑(攻擊傾向)(圖4D)。
GSK2795039完全逆轉(zhuǎn)所有行為異常(圖4B-D)。
意義:Aβ通過NOX2誘發(fā)AD早期神經(jīng)精神癥狀(焦慮、攻擊性)。
5. 研究結(jié)論
1.NOX2是AD起始關(guān)鍵節(jié)點(diǎn):Aβ???? → 激活NOX2 → 氧化應(yīng)激 → 抑制糖酵解 → 腦葡萄糖低代謝。
2.代謝-神經(jīng)功能耦聯(lián):葡萄糖低代謝 → 神經(jīng)網(wǎng)絡(luò)超興奮 → 癲癇樣放電及行為異常。
3.治療靶點(diǎn)驗(yàn)證:NOX2抑制劑GSK2795039阻斷上述病理級聯(lián),具臨床轉(zhuǎn)化潛力。
4.修正AD模型:早期AD以糖酵解障礙為主(線粒體功能尚存),顛覆傳統(tǒng)"線粒體衰竭"假說。
6. 丹麥Unisense電極的核心價(jià)值
(1) 技術(shù)優(yōu)勢
多參數(shù)實(shí)時(shí)同步監(jiān)測:
氧分壓(pO?)電極:直接量化組織氧耗(圖1D),發(fā)現(xiàn)Aβ誘導(dǎo)代償性耗氧↑。
葡萄糖/乳酸酶電極:實(shí)時(shí)捕捉刺激后代謝瞬態(tài)變化(圖1A-B),證實(shí)葡萄糖攝取↓早于電活動改變。
高時(shí)空分辨率:
電極尖端直徑25μm(方法部分),實(shí)現(xiàn)細(xì)胞微環(huán)境動態(tài)追蹤(如CA1區(qū)糖酵解瞬時(shí)抑制)。
(2) 顛覆性發(fā)現(xiàn)
1.揭示"代謝悖論":
Unisense數(shù)據(jù)首次證實(shí):
Aβ抑制糖酵解(NAD(P)H超射↓)但增強(qiáng)氧化磷酸化(氧耗↑)(圖1C-D)。
→ 修正AD"線粒體功能障礙"傳統(tǒng)觀點(diǎn),提出"糖酵解優(yōu)先受損"新機(jī)制。
2.明確NOX2的核心地位:
通過抑制NOX2(GSK2795039)或基因敲除(Cybb<sup>tm1din/J</sup>),完全逆轉(zhuǎn)Aβ的代謝抑制效應(yīng)(圖2)。
→ 為抗氧化治療提供精準(zhǔn)靶點(diǎn)(非廣譜抗氧化劑)。
(3) 臨床轉(zhuǎn)化意義
早期診斷標(biāo)志物:
刺激后葡萄糖瞬態(tài)振幅變化(圖1B)可作為AD超早期無創(chuàng)生物標(biāo)志物。
治療評估工具:
Unisense實(shí)時(shí)監(jiān)測GSK2795039的代謝保護(hù)效果(圖2),加速藥物臨床轉(zhuǎn)化。
機(jī)制驅(qū)動療法:
否定單純抗氧化策略(無效臨床試驗(yàn)),確立NOX2特異性抑制為AD預(yù)防新方向。
核心圖示:Aβ-NOX2-低代謝級聯(lián)
Aβ???? → 激活NOX2 → 氧化應(yīng)激 → 抑制糖酵解 → 葡萄糖低代謝
↓
能量危機(jī) → 神經(jīng)網(wǎng)絡(luò)超興奮 → 癲癇樣放電/行為異常
↓
NOX2抑制劑(GSK2795039)阻斷全程
總結(jié):
本研究通過整合離體腦片-在體電生理-行為學(xué)多維模型,揭示NOX2是Aβ誘發(fā)腦低代謝的核心機(jī)制。丹麥Unisense電極的高精度代謝監(jiān)測能力為發(fā)現(xiàn)"糖酵解特異性抑制"提供關(guān)鍵技術(shù)支撐,推動AD早期診斷與靶向NOX2的精準(zhǔn)治療策略。