熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Light-controlled oxygen production and collection for sustainable photodynamic therapy in tumor hypoxia
光控制氧的生產和收集可持續光動力治療腫瘤缺氧
來源:Biomaterials 269 (2021) 120621
1. 論文摘要核心內容
研究提出一種 光控可持續光動力療法(PDT) 策略:
小球藻(Chlorella) 在光照下通過光合作用持續產氧,逆轉腫瘤缺氧環境。
全氟碳化合物(PFC)納米顆粒 富集氧氣至光敏劑(Ce6)周圍,解決PDT耗氧導致的局部缺氧問題。
雙重機制:
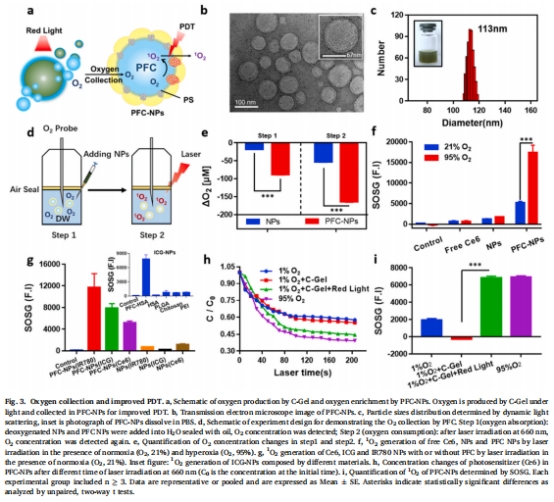
光照階段:小球藻產氧 + PFC富集氧 → 顯著提升單線態氧(1O?)產量(圖3i)。
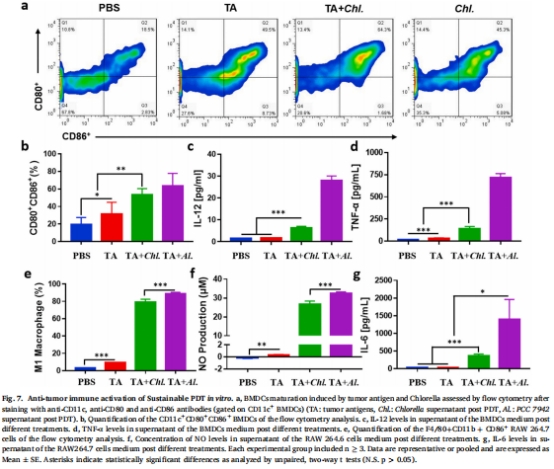
光照后階段:小球藻作為免疫佐劑激活樹突狀細胞(DCs),增強抗腫瘤免疫(圖7)。
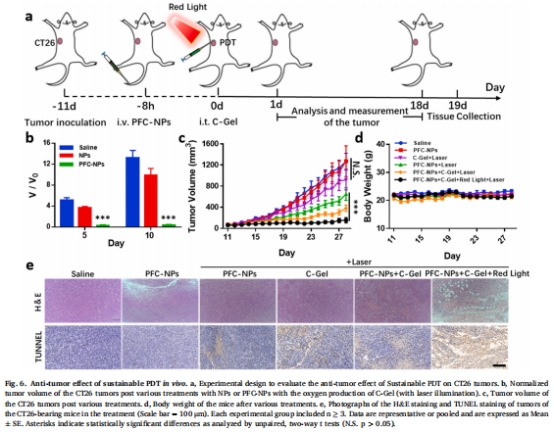
療效:在結腸癌(CT26)模型中,腫瘤抑制率達 90%(圖6c),30%完全消融。
2. 研究目的
解決腫瘤缺氧對PDT療效的限制,通過 光合作用供氧 + 氧氣富集 提升PDT效率,并探索小球藻的免疫調節作用以抑制腫瘤復發。
3. 研究思路
1.材料設計:
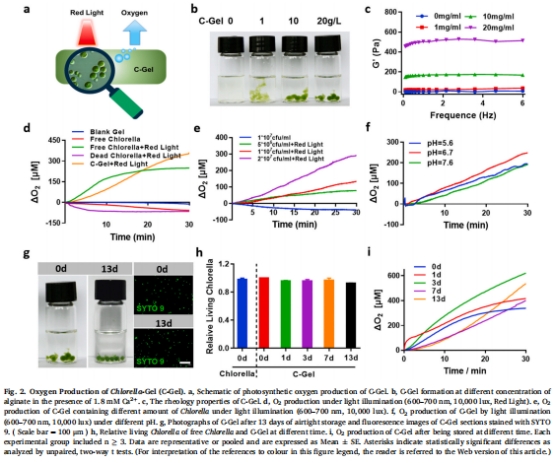
小球藻凝膠(C-Gel):藻酸鈉包裹小球藻形成凝膠(圖2a),保護藻細胞并增強產氧穩定性(圖2g-i)。
PFC納米顆粒(PFC-NPs):負載光敏劑Ce6和全氟三丁胺(PFTBA),通過高氧溶解度富集氧氣(圖3b-c)。
2.作用機制驗證:
產氧能力:C-Gel光照下溶解氧(DO)濃度提升至500 μM(圖2d),顯著降低缺氧標志物HIF-1α(圖4b-c)。
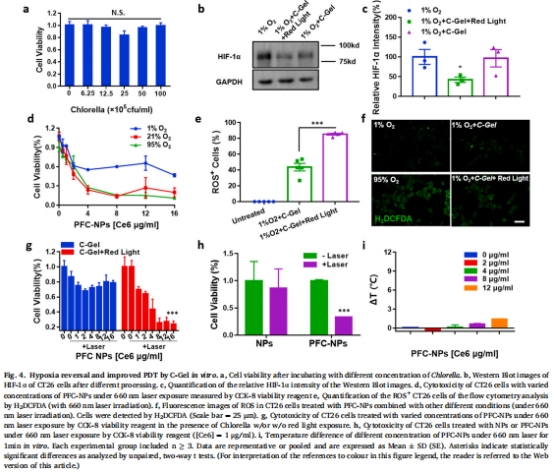
氧氣富集:PFC-NPs收集氧氣并提升Ce6周圍氧濃度,1O?產量達普通納米顆粒的10倍(圖3f)。
3.體內抗腫瘤評價:
小鼠CT26腫瘤模型分6組(圖6a),聯合C-Gel(瘤內注射)和PFC-NPs(靜脈注射)。
660 nm激光激活PDT,監測腫瘤體積、免疫細胞浸潤及組織凋亡(圖6c-e)。
4. 關鍵數據及研究意義
(1) 小球藻產氧與缺氧逆轉(圖2 & 圖4)
數據:
C-Gel光照下DO濃度達 500 μM(圖2d),pH耐受性強(圖2f)。
腫瘤內HIF-1α表達降低50%(圖5e-f),證實缺氧逆轉。
意義:C-Gel提供可控、持續的生物學氧源,克服傳統供氧方式(如H?O?分解)的局限性。
(2) PFC富集氧增強PDT(圖3)
數據:
PFC-NPs使Ce6周圍氧濃度提升2倍(圖3e),1O?產量在95%高氧環境下提升10倍(圖3f)。
與C-Gel聯用后,Ce6降解率與95%高氧組相當(圖3h),證實高效氧利用。
意義:PFC解決PDT耗氧速度>氧氣擴散速度的核心矛盾(6.9 μM/s vs 1.7 μM/s)。
(3) 抗腫瘤效果與免疫激活(圖6 & 圖7)
數據:
腫瘤抑制:聯合治療組腫瘤體積縮小90%(圖6c),TUNEL染色顯示廣泛凋亡(圖6e)。
免疫激活:光照后小球藻促進DC成熟(CD80?CD86?細胞增加),IL-12和TNF-α分泌提升(圖7a-d)。
意義:小球藻兼具 供氧 與 免疫佐劑 雙重功能,協同PDT實現長效抗腫瘤免疫。
5. 結論
1.可持續PDT策略:光控小球藻產氧 + PFC富集氧,顯著提升PDT在缺氧腫瘤中的療效。
2.免疫協同效應:小球藻激活DCs和M1型巨噬細胞,放大抗腫瘤免疫應答。
3.臨床潛力:該系統為晚期癌癥治療提供新思路,尤其適用于缺氧性耐藥腫瘤。
6. 丹麥Unisense電極的核心價值
(1) 技術角色
精準量化溶解氧(DO):
使用Unisense OX-NP針式傳感器(方法4.6)實時監測C-Gel產氧動態(圖2d, 5b)。
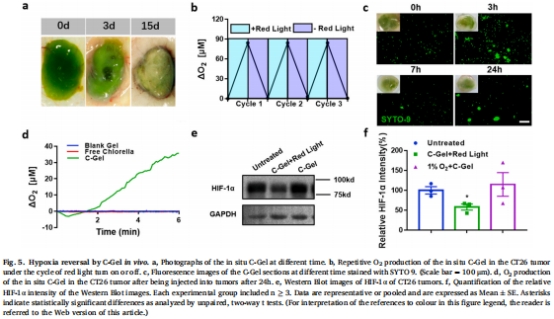
關鍵數據:證實C-Gel在體產氧濃度達 0.6 mmol/L(圖5d),為PFC富集提供基礎。
(2) 研究意義
機制驗證基石:
直接測量腫瘤內氧分壓變化(圖5b),證明C-Gel光照下DO濃度瞬時提升30倍(vs. 游離小球藻)。
驗證PFC-NPs的氧富集能力:激光照射后,PFC-NPs組氧消耗速率是普通NPs的2倍(圖3e)。
方法學創新:
解決氣體溶解度測量的技術難點,為光控氧療提供金標準。
首次在體內量化光合作用-PDT的氧動力學,奠定劑量優化基礎。
(3) 科學價值
療效關聯性:Unisense數據證明氧濃度與PDT效率正相關(圖3i),為"氧氣生產-收集"理論提供直接證據。
轉化醫學啟示:高靈敏度氧監測助力臨床PDT方案標準化,尤其適用于實時調控光照參數。
總結
本研究通過 光合作用供氧 + PFC富集氧 的雙重策略,突破PDT的缺氧限制。丹麥Unisense電極在 氧動力學量化 中發揮不可替代的作用:其微米級空間分辨率和實時監測能力,不僅驗證了C-Gel的持續產氧效能,更揭示了PFC的氧氣富集機制,為光控可持續PDT的臨床轉化提供扎實的實驗依據。未來可基于此技術探索個體化光照方案,以優化抗腫瘤免疫與氧利用的協同效應。