熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Inhaled H2 or CO2 Do Not Augment the Neuroprotective Effect of Therapeutic Hypothermia in a Severe Neonatal Hypoxic-Ischemic Encephalopathy Piglet Model
吸入H 2 或CO2不會增強嚴重新生兒缺氧缺血性腦病仔豬模型中低溫治療的神經保護作用
來源:Int. J. Mol. Sci. 2020, 21, 6801;
1. 論文摘要核心內容
研究通過建立嚴重HIE豬模型(20分鐘窒息誘導),評估了低溫療法(TH)單獨或聯合吸入H?(2.1%)或CO?(分級恢復正常碳酸血癥)的神經保護效果。結果顯示:
TH僅在尾狀核(caudate nucleus)顯著減輕神經元損傷,但對海馬區(hippocampus)無效。
H?或CO?聯合TH未增強神經保護作用;CO?甚至可能削弱TH在尾狀核的保護效果。
基因表達分析:海馬區凋亡誘導因子(AIF)和半胱天冬酶-3(caspase-3)mRNA水平在TH組升高10倍,與TH的區域特異性保護效果一致。
結論:不支持H?或CO?作為TH的輔助療法用于HIE治療。
2. 研究目的
評估H?或CO?能否增強TH的神經保護作用,以改善嚴重HIE患兒的預后。
探究窒息后腦區特異性損傷機制及TH的分子調控(BDNF、AIF、caspase-3基因表達)。
3. 研究思路
1.動物模型建立:
新生豬窒息模型(20分鐘4% O? + 20% CO?通氣),模擬嚴重HIE(圖1)。
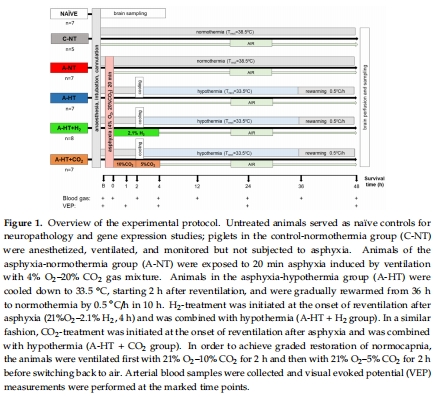
2.分組設計:
對照組(C-NT)、窒息+常溫(A-NT)、窒息+低溫(A-HT)、A-HT+H?、A-HT+CO?(圖1)。
3.干預措施:
TH(33.5°C,窒息后2–36小時);H?(窒息后4小時);CO?(分級恢復碳酸血癥)。
4.多維度評估:
生理參數(體溫、血壓、血氣,圖2–3)。
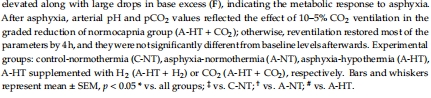
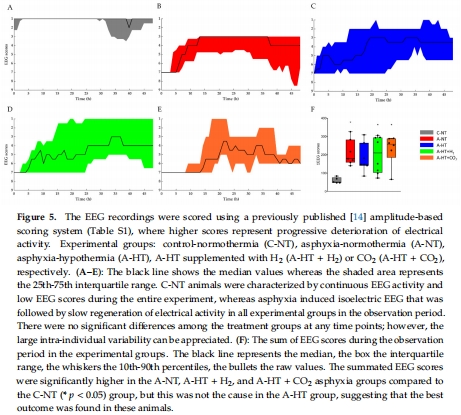
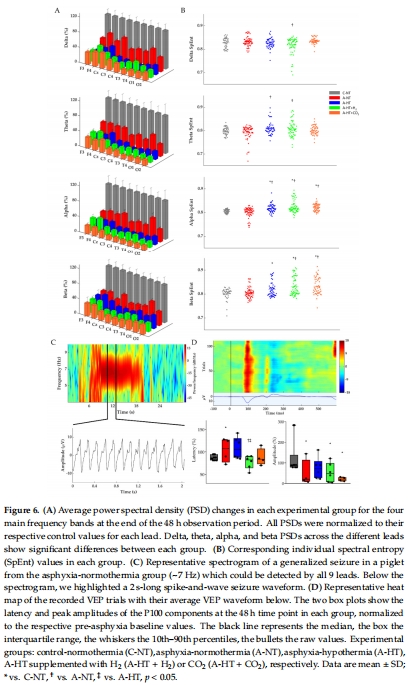
腦電活動(EEG功率譜密度PSD、頻譜熵SpEnt、視覺誘發電位VEP,圖5–6)。
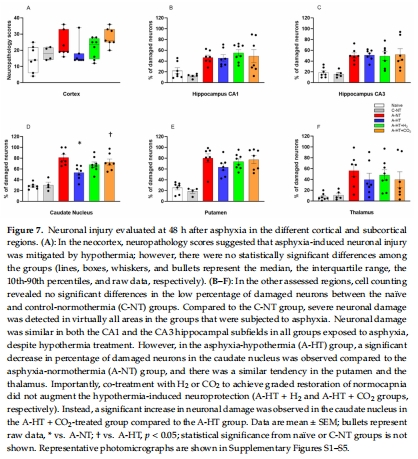
神經病理學(神經元損傷評分,圖7)。
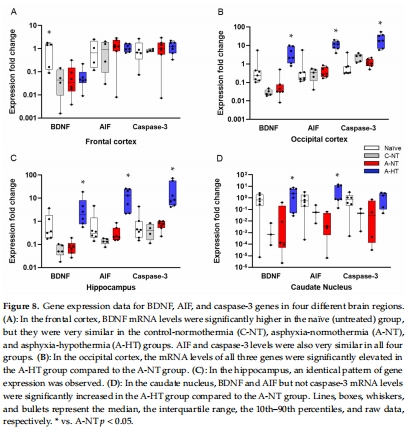
基因表達(BDNF、AIF、caspase-3 mRNA,圖8)。
4. 關鍵數據及研究意義
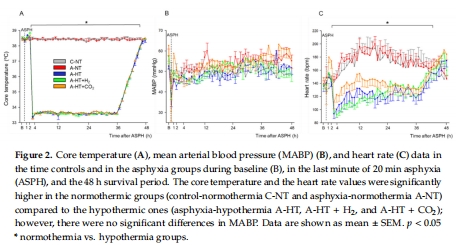
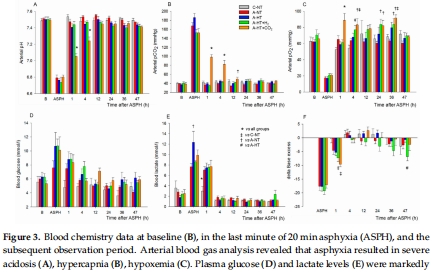
(1) 生理參數(圖2–3)
數據:窒息導致嚴重低氧(pO?=19±5 mmHg)、混合酸中毒(pH=6.79±0.10),TH降低心率(圖2C)。
意義:證實模型成功模擬臨床嚴重HIE,TH對心血管系統有顯著影響。
(2) 腦組織H?濃度(圖4)

數據:使用丹麥Unisense H?微電極實時監測,H?吸入后10–15分鐘腦皮質H?濃度達穩態(13.1±3.4 μM)。
意義:首次在大型動物中直接證實H?可快速穿透血腦屏障,為H?療法的藥代動力學提供關鍵證據。
(3) 腦電活動(圖5–6)
數據:
EEG評分顯示窒息后電活動抑制,TH組恢復最佳(圖5F)。
VEP的P100波幅衰減(圖6D),提示視覺通路損傷。
意義:EEG和VEP是HIE神經功能損傷的敏感指標,TH可部分改善電生理異常。
(4) 神經病理學(圖7)
數據:
TH顯著減少尾狀核神經元損傷(圖7B–F),但對海馬區無效。
CO?聯合TH加重尾狀核損傷(圖7D)。
意義:TH的保護作用具有腦區特異性,CO?可能干擾TH的神經保護機制。
(5) 基因表達(圖8)
數據:
TH上調海馬區BDNF、AIF、caspase-3 mRNA(圖8C),尾狀核僅BDNF和AIF升高(圖8D)。
意義:基因表達差異解釋了TH的區域特異性保護效果,提示凋亡通路參與HIE損傷。
5. 丹麥Unisense電極數據的深層意義
(1) 技術應用背景
電極型號:Unisense H?微電極(直徑50μm),CAL300校準系統(方法部分)。
功能:實時監測腦組織H?濃度,驗證H?吸入治療的生物可利用度。
(2) 研究意義
1.治療劑量的直接證據:
測得腦組織H?濃度(13.1±3.4 μM)與嚙齒類神經保護研究中的有效濃度一致(圖4),證實H?可達到治療水平。
2.動力學特征:
H?濃度在10–15分鐘達穩態,支持早期干預的可行性(窒息后立即給藥)。
3.轉化醫學價值:
為大型動物模型中的H?藥代動力學研究設立金標準,克服了既往依賴間接血藥濃度的局限。
4.局限性啟示:
未監測窒息或低溫狀態下H?濃度變化,未來需結合動態腦血流數據優化給藥方案。
6. 研究結論
1.TH的局限性:僅對尾狀核有保護作用,海馬區損傷未改善。
2.輔助療法無效:H?或CO?聯合TH無協同保護作用,CO?可能拮抗TH效果。
3.分子機制:TH通過上調BDNF和凋亡相關基因(AIF/caspase-3)發揮區域特異性保護,但可能同時激活促凋亡通路。
4.臨床意義:不支持H?或CO?作為TH的輔助療法用于嚴重HIE。
7. 核心圖示
TH的區域特異性保護與輔助療法失敗機制:
[窒息損傷] → [TH激活尾狀核BDNF/AIF] → [神經保護]
↑
[海馬區凋亡基因持續高表達] → [TH無效]
↓
[CO?干擾TH保護] → [尾狀核損傷加重]
研究啟示:
丹麥Unisense電極通過高時空分辨率實時監測腦組織H?濃度,為氣體療法的轉化研究提供了不可替代的藥代動力學證據。未來需探索H?在低溫或缺血條件下的滲透規律,并聯合多模態監測(如腦血流、代謝)以優化神經保護策略。