熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Cell Cycle, Filament Growth and Synchronized Cell Division in Multicellular Cable Bacteria
在延時成像孵化系統中,父系對胚胎細胞分裂的早期和晚期貢獻
來源:Frontiers in Microbiology 1 January 2021 | Volume 12 | Article 620807
1. 摘要核心內容
本研究通過結合雙標記穩定同位素探測(13C和1?N)、納米二次離子質譜(nanoSIMS)、熒光顯微鏡和基因組分析,揭示了電纜細菌(cable bacteria)獨特的細胞周期與生長機制:
細胞周期與單細胞細菌相似:電纜細菌的細胞分裂過程與革蘭氏陰性模型菌(如大腸桿菌)高度保守(圖6)。

同步化細胞分裂:同一絲狀體內的細胞在毫米尺度上呈現高度同步的分裂行為(圖3-4),這是由長距離電子傳輸驅動的獨特現象。

“氧氣起搏器”模型:提出新模型解釋同步分裂機制——電纜細菌僅在接觸氧氣時啟動長距離電子傳輸,從而觸發全絲同步生長與分裂(圖7)。

2. 研究目的
解析電纜細菌的細胞周期:明確其細胞分裂、絲狀生長與單細胞細菌的異同。
揭示同步分裂機制:探索多細胞絲狀體中細胞分裂同步化的驅動因素。
建立代謝-生長關聯:闡明長距離電子傳輸(LDET)如何調控碳氮同化與細胞增殖。
3. 研究思路
模型構建:
從荷蘭鹽沼沉積物中富集電纜細菌(Candidatus Electrothrix屬)。
構建雙標記SIP實驗(13C-碳酸氫鹽/丙酸鹽 + 1?N-銨鹽),標記時長為6h和24h。
多尺度觀測:
單細胞尺度:nanoSIMS成像分析13C/1?N同化空間分布(圖2-3)。

絲狀體尺度:熒光顯微鏡(DAPI染色)觀察染色體分離狀態(圖5)。
基因組尺度:比對電纜細菌與近緣菌(Desulfobulbus)的細胞分裂基因簇(表2)。
環境關聯:
微電極測量沉積物O?/H?S/pH剖面(方法部分),定位氧化-亞氧化分區。
從氧化區(0-2 mm)和亞氧化區(5-10 mm)分別分離絲狀體分析。
4. 關鍵數據及研究意義
(1) 同位素同化均勻性(圖1 & 表1)
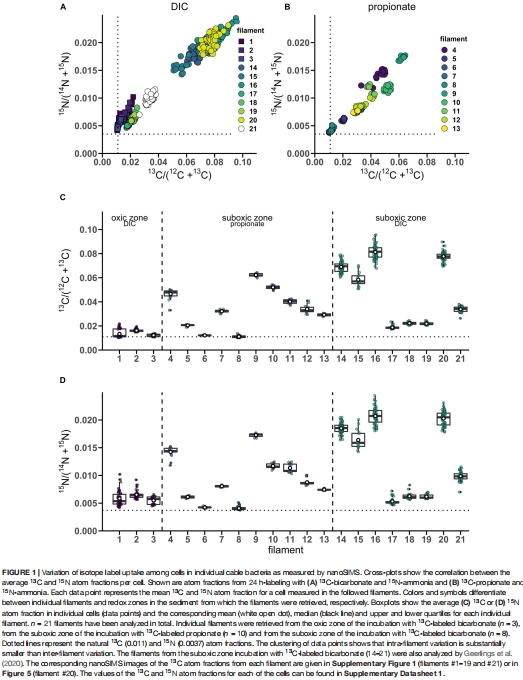

數據來源:nanoSIMS分析21根絲狀體(596個細胞)的13C/1?N原子分數。
發現:同一絲狀體內細胞間同位素富集變異系數(CV)僅2-10%(表1),而絲狀體間差異顯著(圖1A-B)。
意義:證明電纜細菌的碳氮同化在絲狀體內部高度均一,支持分布式生長模式(非頂端生長)。
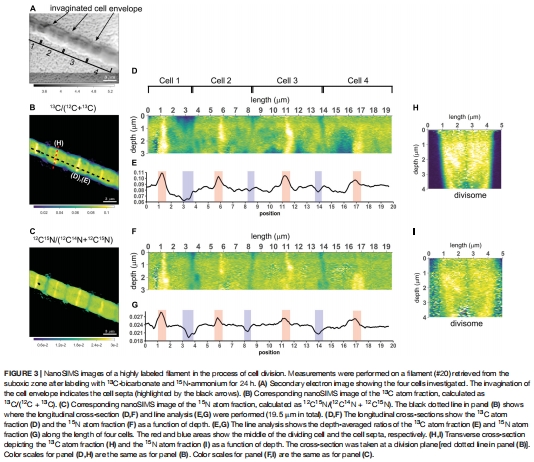
(2) 同步化細胞分裂證據(圖3-4)
數據來源:高分辨率nanoSIMS成像(如絲狀體#20)。
發現:
分裂期細胞中段出現13C/1?N富集盤狀結構(圖3B-C),代表新合成的分裂體(divisome)。
同一絲狀體上相距2.3 mm的細胞同步出現分裂帶(圖4)。
意義:首次證實電纜細菌存在毫米級同步分裂,顛覆了傳統細菌異步分裂的認知。
(3) 氧化區與亞氧化區細胞狀態差異(圖5)
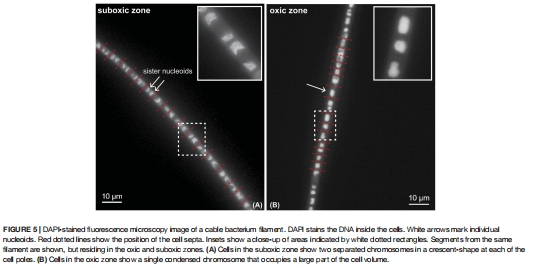
數據來源:DAPI染色熒光顯微鏡觀察。
發現:
亞氧化區細胞:染色體分離為新月形極定位(圖5A),指示活躍分裂。
氧化區細胞:染色體呈單一大塊狀(圖5B),無分裂跡象。
意義:證實細胞分裂僅發生于亞氧化區(硫氧化細胞),氧化區細胞(氧還原細胞)不增殖。
(4) 細胞分裂基因保守性(表2)

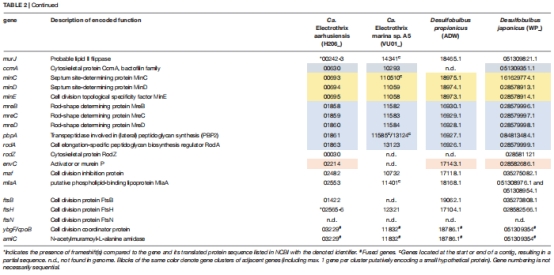
數據來源:基因組比對(電纜細菌 vs. Desulfobulbusvs. 大腸桿菌)。
發現:
保守基因:ftsZ(Z環形成)、ftsA(膜錨定)、minCDE(分裂位點定位)等。
缺失基因:zipA(膜連接蛋白)、ftsN(分裂體激活因子)。
意義:電纜細菌分裂機制與單細胞細菌相似,但存在特異性調控(如缺失ftsN可能通過其他蛋白補償)。
5. 核心結論
細胞周期三階段模型(圖6):
階段1(伸長):側向細胞包膜均一延伸(圖2A-B)。
階段2(分裂啟動):染色體復制后形成Z環(圖2E-F)。
階段3(分裂完成):分裂體組裝與隔膜合成(圖3D)。
氧氣驅動同步分裂機制(“氧氣起搏器”模型,圖7):
絲狀體需接觸氧氣(“接入”狀態)才能啟動LDET和能量合成。
氧氣中斷(“斷開”狀態)導致代謝停滯,重啟后觸發全絲同步生長與分裂。
代謝分區與生長限制:
僅亞氧化區細胞(硫氧化)能同化碳氮并分裂。
氧化區細胞(氧還原)僅傳遞電子,不增殖。
6. 丹麥Unisense電極數據的詳細解讀
技術原理與方法
設備型號:Unisense微電極系統(O?、H?S、pH傳感器)。
工作原理:
O?微電極:基于電化學還原反應(O? + 4H? + 4e? → 2H?O),電流強度與O?濃度成正比。
H?S微電極:通過擴散層測量H?S氧化電流。
pH微電極:玻璃電極響應H?活度變化。
實驗流程:
傳感器校準后插入沉積物,以50-100 μm步進測量剖面。
記錄O?/H?S/pH隨深度變化,定位氧化-還原界面。
研究意義
驗證代謝分區假設:
數據顯示O?在0-2 mm深度耗盡,H?S在>5 mm深度出現(方法部分)。
關鍵證據:證實電纜細菌的“陽極細胞”(亞氧化區)與“陰極細胞”(氧化區)空間分離,為LDET提供環境基礎。
量化電子傳遞驅動力:
pH剖面顯示氧化區酸中毒(H?積累)、還原區堿化(OH?積累)(方法部分)。
機制關聯:跨區pH梯度(ΔpH≈2)是LDET的質子驅動力來源,支持能量守恒模型。
指導SIP實驗設計:
微電極數據界定氧化/亞氧化分區,確保同位素標記細胞(亞氧化區)與無標記細胞(氧化區)的精準分離。
技術優勢
高空間分辨率:μm級精度捕捉沉積物微環境梯度。
原位無損測量:避免沉積物擾動,真實反映電纜細菌生境。
多參數同步:O?/H?S/pH聯測揭示氧化還原耦合機制。
總結
本研究通過多學科技術整合,首次揭示電纜細菌的同步化細胞分裂機制及其與長距離電子傳輸的偶聯關系。丹麥Unisense電極數據為代謝分區提供了關鍵環境證據,而nanoSIMS與基因組分析則從單細胞到分子水平解析了分裂同步性的成因。提出的“氧氣起搏器”模型為理解多細胞細菌的群體行為提供了新范式,也為人工調控電纜細菌在生物修復中的應用奠定理論基礎。