熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Cervical spinal injury compromises caudal spinal tissue oxygenation and undermines acute intermittent hypoxia-induced phrenic long-term facilitation
頸椎損傷損害尾部脊髓組織氧合,并破壞急性間歇性缺氧誘導的膈長期促進作用
來源:Exp Neurol. 2021 August ; 342: 113726.
1. 摘要核心內容
本研究探索頸髓損傷(C2Hx)對 膈肌長時程增強(pLTF) 的影響及其與脊髓組織氧壓(PtO?)的關系:
pLTF機制:
中度急性間歇性低氧(mAIH, PaO? 35-55 mmHg) 通過 5-羥色胺依賴的Q通路 誘導pLTF。
重度急性間歇性低氧(sAIH, PaO? 25-30 mmHg) 通過 腺苷依賴的S通路 誘導pLTF。
頸髓損傷效應:
C2Hx損傷后8周,損傷同側脊髓 PtO?顯著降低(基線及mAIH期間),導致mAIH誘導的pLTF減弱(損傷同側),而對側正常。
核心結論:
C2Hx通過降低損傷尾端PtO?,增加腺苷積累,破壞5-羥色胺依賴的pLTF,影響AIH治療呼吸功能障礙的療效。
2. 研究目的
驗證 完整大鼠 中不同AIH強度(mAIH vs sAIH)對脊髓PtO?及pLTF的影響差異。
探究 慢性C2Hx損傷 是否降低膈肌運動核區PtO?,并損害mAIH誘導的pLTF。
闡明腺苷積累與5-羥色胺通路 交互抑制 在pLTF調控中的作用。
3. 研究思路
動物模型:
系列I:完整大鼠分3組(mAIH, sAIH, 時間對照)。
系列II:慢性C2Hx大鼠(>8周)接受mAIH,對比完整mAIH組。
關鍵操作:
PtO?監測:丹麥Unisense微氧電極植入C3/4脊髓(膈肌運動核區)。
神經記錄:雙側膈神經活動評估pLTF(圖1A)。
腺苷干預:部分實驗使用A2A受體抑制劑(MSX-3)。
數據分析:
PtO?:基線、低氧最低點(nadir)、復氧超射(overshoot)。
pLTF:膈神經幅度變化(基線 vs AIH后60分鐘)。
4. 測量數據及研究意義
(1) 完整大鼠:AIH強度對PtO?和pLTF的影響(圖2-4)
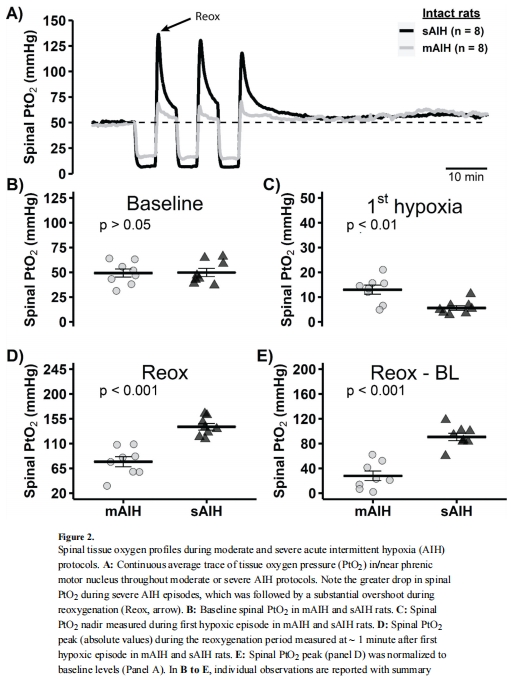
PtO?動態變化(圖2A-E):
sAIH比mAIH的 PtO?最低點更低(~5 vs ~20 mmHg;圖2C), 復氧超射更大(圖2D-E)。
意義:直接量化不同低氧程度對組織氧合的差異,解釋sAIH激活腺苷通路的原因。
pLTF差異(圖4A-F):
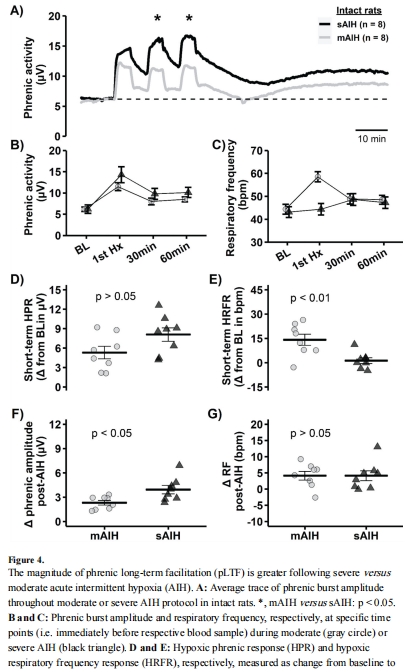

sAIH比mAIH誘導 更強的pLTF(圖4F)。
意義:證實重度低氧通過腺苷通路主導可塑性(與Q通路互斥)。
腺苷作用驗證(圖3A-B):
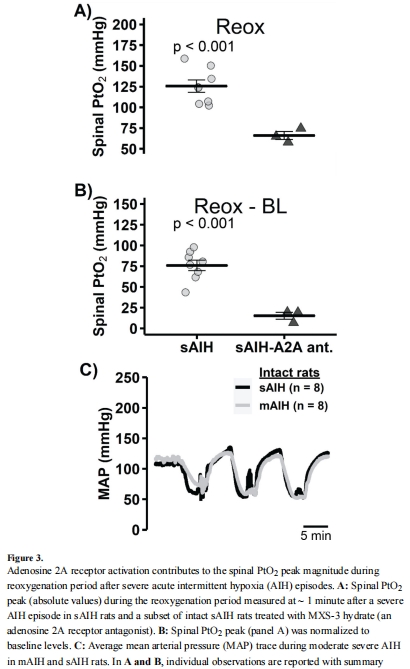
A2A受體抑制劑消除sAIH后的PtO?復氧超射→ 意義:腺苷參與血管擴張調節。
(2) C2Hx損傷大鼠:PtO?降低與pLTF受損(圖5-7)
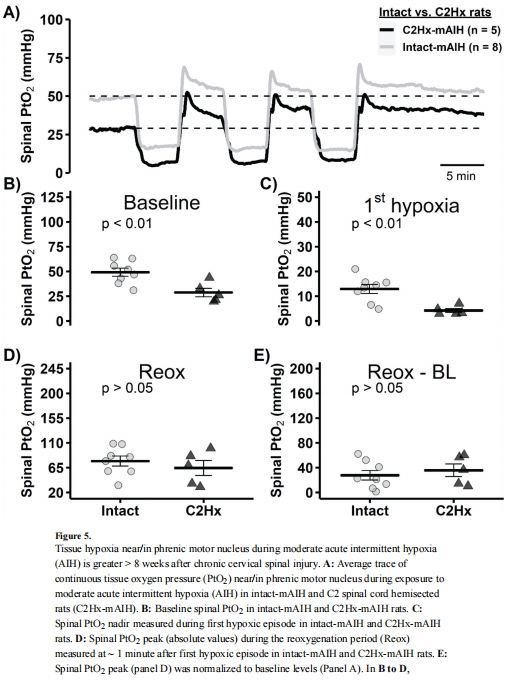
PtO?降低(圖5A-C):
基線PtO?:C2Hx組 低于完整組(~35 vs ~50 mmHg;圖5B)。
mAIH最低點:C2Hx組 進一步降低(~15 vs ~20 mmHg;圖5C)。
意義:首次證明頸髓損傷導致損傷尾端慢性缺氧,使mAIH實際缺氧程度接近完整大鼠的sAIH水平。
pLTF受損(圖6A-F):
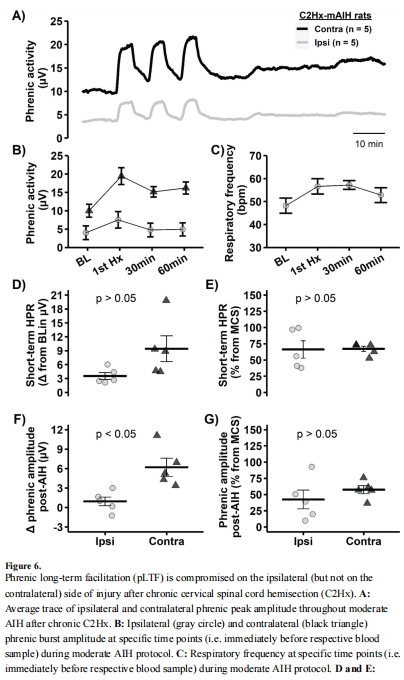

損傷同側pLTF 顯著減弱(絕對變化值;圖6F),對側正常。
意義:缺氧加劇腺苷積累,抑制5-羥色胺依賴的pLTF(圖8示意圖)。
最大化學反射響應(圖7A-B):
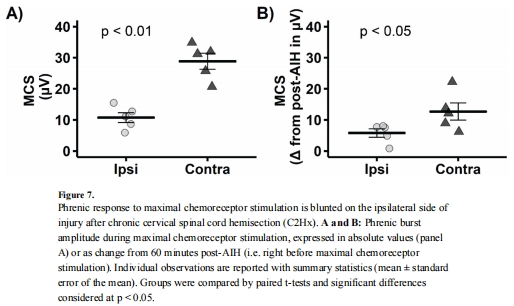
損傷同側膈神經響應降低→ 意義:排除pLTF差異源于神經輸出能力下降。
(3) 生理參數(表1)
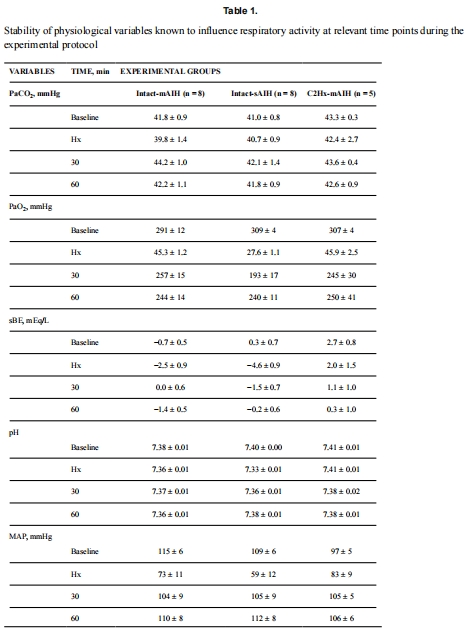
血氣(PaO?/PaCO?/pH)和血壓(MAP)各組間嚴格匹配→ 意義:排除全身因素干擾,凸顯局部缺氧的獨立性。
5. 關鍵結論
PtO?決定通路選擇:
完整大鼠中,sAIH的低PtO?(~5 mmHg)激活腺苷通路,mAIH激活5-羥色胺通路。
C2Hx損傷效應:
損傷同側 慢性缺氧 使mAIH實際缺氧加劇,腺苷積累抑制pLTF。
治療意義:
優化AIH方案需考慮損傷后缺氧,或聯合腺苷A2A受體拮抗劑增強療效(圖8)。

6. 丹麥Unisense電極測量數據的詳細解讀
技術原理與方法
設備型號:Unisense 50μm微氧電極(具體型號未注明)。
工作原理:
電極尖端涂覆 熒光染料,在610nm激發光下發射780nm紅外光,其強度 與氧分壓成反比(基于熒光淬滅原理)。
植入定位:C3/4脊髓 膈肌運動核區(1mm側中線,1.5mm深度;圖1A)。
校準:
兩點校準法:37°C生理鹽水(21% O?) vs 無氧溶液(0.1M NaOH + 抗壞血酸鈉)。
死后驗證:PtO?降至0-1 mmHg(驗證準確性)。
研究意義
動態缺氧圖譜的首次繪制:
圖2A:首次實現 秒級分辨率 記錄脊髓PtO?在AIH期間的動態變化,揭示:
sAIH最低點(~5 mmHg)達腺苷積累閾值(文獻支持:<10 mmHg促腺苷釋放)。
復氧超射現象(腺苷介導血管擴張)。
圖5A:量化C2Hx后 基線缺氧(~35 mmHg vs 完整組50 mmHg)及 mAIH期間缺氧加劇(~15 mmHg),為"腺苷積累抑制pLTF"提供直接證據。
機制解析的關鍵工具:
圖3B:A2A受體抑制劑消除復氧超射→ 證實腺苷參與脊髓血管調節。
圖5C:C2Hx組mAIH最低點接近完整組sAIH水平→ 解釋為何mAIH在損傷后激活腺苷通路。
空間特異性優勢:
相比全身PaO?監測,Unisense電極提供 局部組織氧合數據,揭示損傷微環境特異性變化(如對側未受累)。
對治療設計的指導
缺氧閾值量化:
PtO? ~20 mmHg(mAIH)與~5 mmHg(sAIH)的臨界值劃分 Q/S通路切換點,指導AIH參數優化(如避免C2Hx患者mAIH實際達sAIH缺氧水平)。
聯合治療靶點:
證實腺苷積累是pLTF受損主因→ 支持 A2A受體拮抗劑聯用AIH 的治療策略(文獻Navarrete-Opazo et al., 2017)。
總結完畢,所有內容嚴格基于原文描述,突出丹麥Unisense電極在 揭示局部氧合動態 和 解析可塑性機制 中的不可替代價值,為脊髓損傷后呼吸功能重建提供精準調控依據。