熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Identification of Biochemical and Molecular Markers of Early Aging in Childhood Cancer Survivors
兒童癌癥幸存者早期衰老的生化和分子標志物的鑒定
來源:Cancers 2021, 13, 5214.
1. 摘要核心內(nèi)容
兒童癌癥幸存者(CCS)因化療/放療治療,存在早發(fā)性衰老風險,表現(xiàn)為慢性病高發(fā)和二次腫瘤風險增加。本研究通過對比 196名CCS 與 154名健康人 的單核細胞(MNCs),發(fā)現(xiàn)CCS存在顯著的線粒體能量代謝異常:
氧化磷酸化(OxPhos)效率降低(P/O值下降)
活性氧(ROS)和脂質過氧化(MDA)水平升高
糖酵解增強(LDH活性增加)
關鍵線粒體調控基因(CLUH, PGC1-α, SIRT6)表達下調
基于代謝參數(shù)構建的數(shù)學模型顯示,CCS的"代謝年齡"顯著高于實際年齡,提示早衰機制與線粒體功能障礙密切相關。
2. 研究目的
揭示兒童癌癥幸存者(CCS)早發(fā)性衰老的分子機制,聚焦于:
化療/放療對線粒體能量代謝的長期影響
CCS與健康人群的代謝差異
尋找早衰的生物標志物及潛在治療靶點
3. 研究思路
樣本分組:
CCS組(196人,分3年齡組:<10歲、11-20歲、21-40歲)
健康對照組(79名年齡匹配者 + 79名老年人)
多維度分析:
生化檢測:耗氧率、ATP合成、能量狀態(tài)(ATP/AMP)、氧化應激(ROS/MDA)
蛋白組學:差異表達蛋白(如LDHB、抗氧化酶)
基因表達:線粒體相關基因(CLUH, PGC1-α, SIRT6等)
數(shù)學模型:基于代謝參數(shù)預測"代謝年齡",量化早衰程度。
4. 測量數(shù)據(jù)及研究意義
(1) 線粒體功能與氧化應激(來自Figure 1-3)
P/O值(圖1A-B):
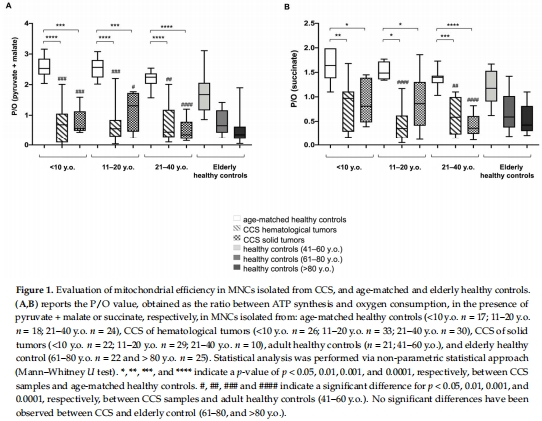
CCS的P/O值(氧化磷酸化效率)顯著低于同齡健康人,接近60歲以上老年人水平。
意義:直接反映線粒體能量轉化功能障礙,是早衰的核心代謝標志。
線粒體膜電位(MMP)(圖2A):
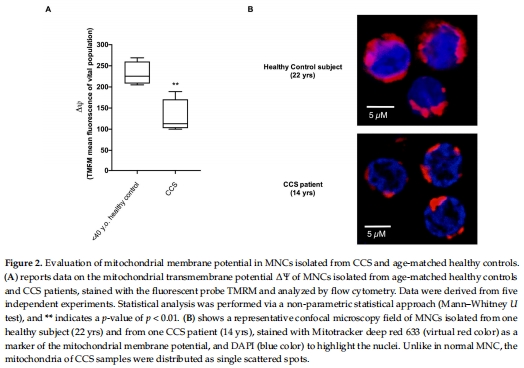
CCS的MMP降低44%,線粒體分布紊亂(圖2B)。
意義:提示線粒體結構損傷和網(wǎng)絡功能失調。
ROS與MDA(圖3A):
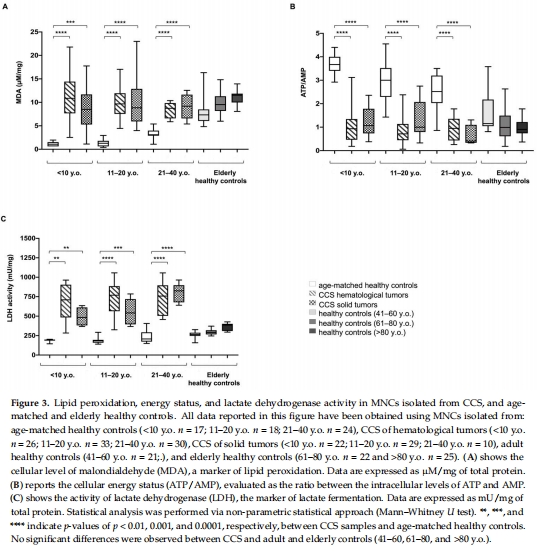
CCS的ROS升高10倍,MDA(脂質過氧化產(chǎn)物)水平與老年人相當。
意義:證實氧化應激累積是早衰的關鍵驅動因素。
(2) 能量代謝與糖酵解轉換(來自Figure 3)
ATP/AMP比值(圖3B):CCS顯著低于同齡人,與老年人相似。
LDH活性(圖3C):CCS的乳酸脫氫酶活性升高。
意義:揭示能量危機迫使細胞轉向糖酵解供能,類似衰老細胞的代謝特征。
(3) 蛋白組學分析(來自Figure 6)
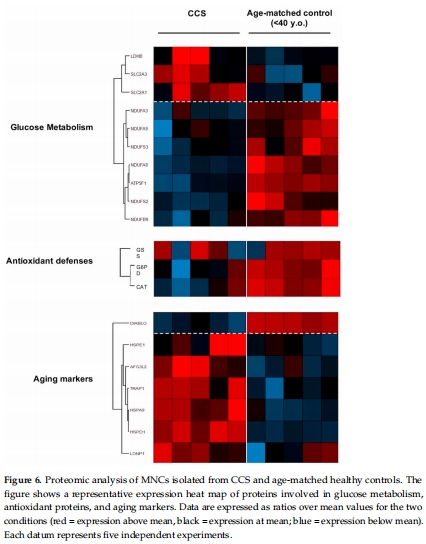
差異蛋白:
上調:糖酵解酶(LDHB)、葡萄糖轉運體(SLC2A1/3)、線粒體應激蛋白(HSPs)
下調:復合體I亞基(NDUFA3等)、抗氧化酶(CAT, GSS)
意義:系統(tǒng)性證實代謝重編程(從OxPhos轉向糖酵解)和抗氧化能力衰退。
(4) 基因表達分析(來自Figure 7)
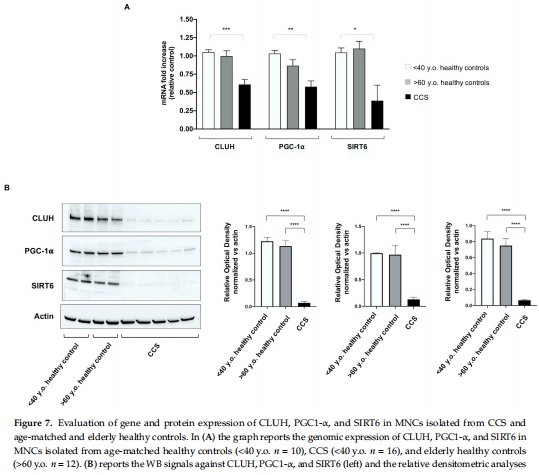
CLUH, PGC1-α, SIRT6 基因和蛋白表達在CCS中顯著下調(圖7A-B),而健康老年人無此現(xiàn)象。
意義:這些基因調控線粒體生物合成與代謝,其缺失是CCS特異性早衰標志。
(5) 代謝年齡模型(來自Figure 5)
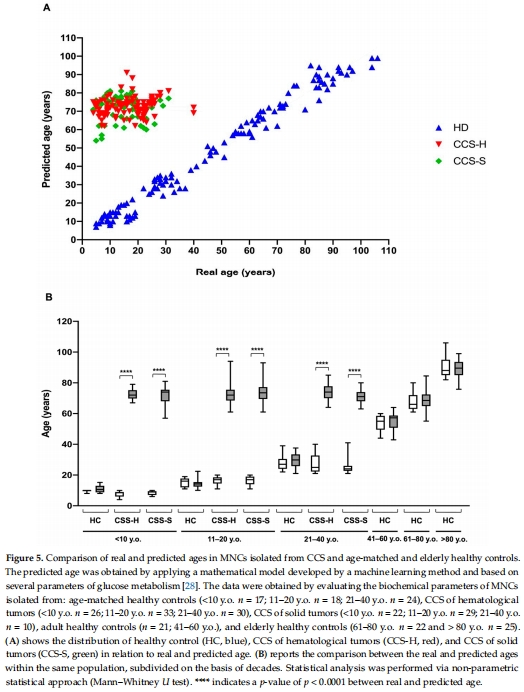
基于 P/O值、ATP/AMP、MDA、LDH 構建數(shù)學模型:
健康人預測年齡與實際年齡高度相關(r=0.98)
CCS預測年齡顯著高于實際年齡(r=0.15)
意義:量化CCS的代謝早衰程度,提供無創(chuàng)評估工具。
5. 關鍵結論
線粒體功能障礙是CCS早衰核心:OxPhos效率降低、ROS累積、糖酵解增強。
特異性分子標志:CLUH/PGC1-α/SIRT6下調是CCS早衰的獨特機制,區(qū)別于生理性衰老。
代謝年齡模型的有效性:為早衰提供客觀量化指標。
治療啟示:靶向線粒體功能恢復(如激活PGC1-α/SIRT6)或可延緩CCS早衰。
6. 丹麥Unisense電極測量數(shù)據(jù)的詳細解讀
數(shù)據(jù)來源(Methods 2.3 及 Figure 1)
檢測原理:
使用丹麥Unisense微氧電極(O?電極),在封閉反應室中實時監(jiān)測MNCs的耗氧率(OCR)。
關鍵實驗:
細胞經(jīng)透化處理后,加入底物(丙酮酸/蘋果酸 或 琥珀酸)激活特定呼吸鏈復合體。
同步測量OCR和ATP合成率,計算 P/O值(ATP合成量/耗氧量)。
研究意義
直接量化線粒體功能:
Unisense電極提供 高時空分辨率 的耗氧動態(tài)數(shù)據(jù),精準反映OxPhos效率(P/O值)。
CCS的P/O值降低(圖1)證明線粒體能量轉化效率受損,是早衰的 直接代謝證據(jù)。
揭示治療特異性損傷:
CCS中接受化療/放療者P/O值顯著降低,而接受骨髓移植者無此現(xiàn)象(圖4),明確損傷源于化療/放療而非癌癥本身。
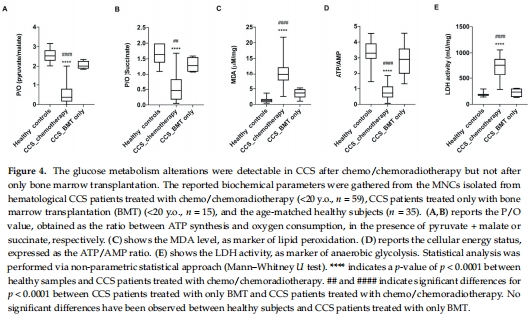
支撐代謝年齡模型:
OCR數(shù)據(jù)是計算P/O值的基礎,而P/O值是代謝年齡模型的 核心參數(shù)(圖5),將生物能量缺陷轉化為可量化的早衰指標。
區(qū)別于傳統(tǒng)方法:
相比靜態(tài)生化檢測,Unisense的 實時動態(tài)監(jiān)測 更靈敏捕捉線粒體功能細微變化,為早衰機制提供深層見解。