熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
A reassessment of the role of oxygen scavenging enzymes in the emergence of metronidazole resistance in trichomonads
重新評估氧清除酶在毛滴蟲甲硝唑耐藥性出現中的作用
來源:International Journal for Parasitology: Drugs and Drug Resistance 16 (2021) 38–44
1. 摘要核心內容
本研究通過比較胎兒毛滴蟲(T. foetus)與陰道毛滴蟲(T. vaginalis)的甲硝唑耐藥機制,發現:
黃素還原酶(FR)活性差異:
T. foetus的FR活性比T. vaginalis低近100倍(圖2A),且與甲硝唑耐藥無關;

T. vaginalis耐藥株FR活性顯著降低(↓75%),但T. foetus耐藥株FR活性未下降(圖2A)。
氧清除機制顛覆性發現:
傳統認為的FR和NADH氧化酶并非主要氧清除酶(圖3);

甲硝唑耐藥與氧清除能力下降無必然因果關聯(耐藥株氧清除速率僅藥物暴露時短暫降低)。
技術突破:丹麥Unisense氧敏感電極證實氧清除速率與FR/NADH氧化酶活性無關,推翻經典耐藥模型。
2. 研究目的
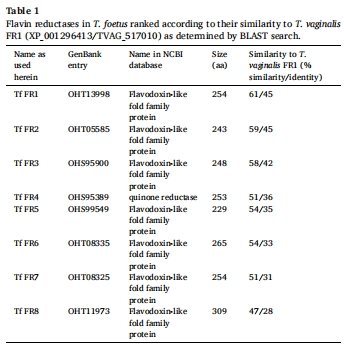
鑒定T. foetus中T. vaginalis FR1同源酶及其活性;
探究FR是否參與T. foetus的甲硝唑耐藥;
驗證"氧清除缺陷導致耐藥"理論在T. foetus中的普適性;
揭示甲硝唑耐藥的核心機制是否依賴氧微環境調控。
3. 研究思路
同源酶篩選→酶活性驗證→耐藥模型構建→氧清除動力學分析:
同源酶鑒定:
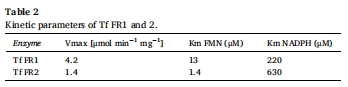
通過BLAST比對發現T. foetus存在8個FR同源基因(表1),僅Tf FR1/2具活性(表2);
凝膠電泳分離確認Tf FR1為主要活性酶(圖1A)。
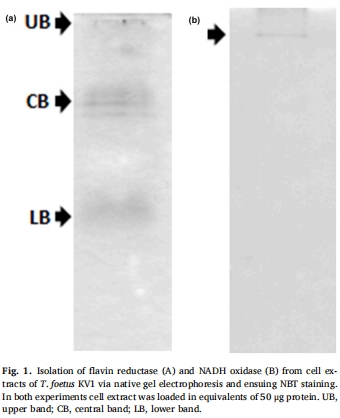
酶活性與耐藥關聯:
測定敏感/耐藥株FR及NADH氧化酶活性(圖2A-B);
T. foetus耐藥株FR活性不變,NADH氧化酶僅在藥物暴露時抑制(非永久性缺陷)。
氧清除動力學:
使用Unisense氧電極實時監測細胞氧消耗速率(圖3);
發現氧清除速率與FR/NADH氧化酶活性無相關性(推翻傳統模型)。
4. 關鍵數據及研究意義
(1)黃素還原酶(FR)活性(圖2A)
數據:
T. foetus KV1株FR活性僅為T. vaginalis C1株的1/10;
T. foetus耐藥株(100 μM甲硝唑)FR活性未下降,而T. vaginalis耐藥株活性↓75%。
意義:首次證實FR活性缺失是T. vaginalis特有耐藥機制,非跨物種普適規律。
(2)NADH氧化酶活性(圖2B-C)
數據:
T. foetus耐藥株NADH氧化酶活性↓75%(僅藥物暴露時),撤藥后恢復;
T. vaginalis耐藥株(B7268/CDC085)NADH氧化酶活性正常,但敏感株C1天然缺失該酶。
意義:NADH氧化酶抑制是甲硝唑的藥物副作用,非耐藥成因。
(3)氧清除速率(圖3)
數據(Unisense電極測量):
T. foetus耐藥株氧清除速率↓50%(僅藥物暴露時),撤藥后恢復;
T. vaginalis耐藥株(B7268/CDC085)氧清除減慢,但敏感株C1(無NADH氧化酶)清除速率正常。
意義:氧清除能力與FR/NADH氧化酶活性解耦,提示存在未知氧清除途徑。
5. 核心結論
物種特異性耐藥機制:FR缺失是T. vaginalis耐藥關鍵,但T. foetus依賴其他通路;
氧清除模型被推翻:FR和NADH氧化酶非主要氧清除酶,其活性與氧消耗速率無關;
耐藥本質新認知:甲硝唑耐藥與氧微環境調控無直接因果,可能為表觀遺傳適應性改變。
6. 丹麥Unisense電極的研究意義
技術原理與數據:
功能:采用Unisense氧敏感電極(微電極)實時監測封閉培養體系中溶解氧濃度:
動態監測:每30秒記錄氧濃度變化,持續60分鐘(方法部分);
關鍵實驗:測量敏感/耐藥株在藥物暴露/撤藥后的氧清除速率(圖3A-C)。
關鍵參數:
基線校準:無細胞培養基背景氧消耗作為對照;
速率計算:氧濃度下降斜率反映細胞氧清除能力。
科學價值:
推翻經典理論:
直接證明T. foetus耐藥株氧清除缺陷僅短暫存在(撤藥后恢復),否定"永久性氧清除缺陷導致耐藥"假說;
揭示T. vaginalis敏感株(C1)雖無NADH氧化酶,但氧清除速率正常(圖3C),提示未知氧清除途徑。
技術優勢凸顯:
高時空分辨率:秒級監測捕捉氧消耗動態,避免終點法誤差;
活細胞兼容:非侵入性測量保持細胞生理狀態,反映真實微環境響應。
領域范式革新:
確立氧電極作為寄生蟲微環境研究金標準,替代間接酶活性推測;
為耐藥機制研究提供直接生理證據,推動從"酶中心論"向"系統生理學"轉變。
臨床啟示:
解釋T. foetus臨床耐藥復雜性:短暫藥物暴露可逆影響氧代謝,但非耐藥本質;
提示靶向未知氧清除途徑可能是克服耐藥新策略。
機制示意圖:
傳統模型:
甲硝唑耐藥 → FR/NADH氧化酶↓ → 氧清除↓ → 細胞內氧↑ → 藥物激活↓
本研究修正:
甲硝唑暴露 → 可逆性抑制NADH氧化酶 → 短暫氧清除↓
耐藥本質 → 表觀遺傳調控(非氧依賴通路)
創新點:
首次在寄生蟲學領域應用實時氧監測技術推翻長達40年的耐藥理論;
揭示甲硝唑耐藥機制的物種特異性,警示跨物種外推結論的風險。