熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Zinc oxide nanosphere for hydrogen sulfide scavenging and ferroptosis of colorectal cancer
用于結(jié)直腸癌硫化氫清除和鐵死亡的氧化鋅納米球
來源:Pan et al. Journal of Nanobiotechnology (2021) 19:392
1. 摘要核心內(nèi)容
本研究開發(fā)了一種硫化氫(H?S)響應(yīng)型納米平臺(tái)(VZnO),通過清除結(jié)直腸癌(CRC)中高表達(dá)的H?S誘導(dǎo)癌細(xì)胞鐵死亡。關(guān)鍵發(fā)現(xiàn):
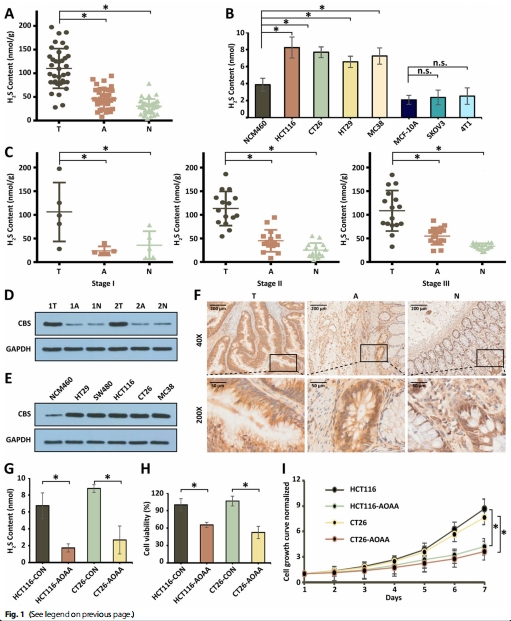
H?S在CRC中特異性高表達(dá):臨床樣本和細(xì)胞實(shí)驗(yàn)證實(shí)CRC組織H?S濃度顯著高于正常組織(圖1A-C)。

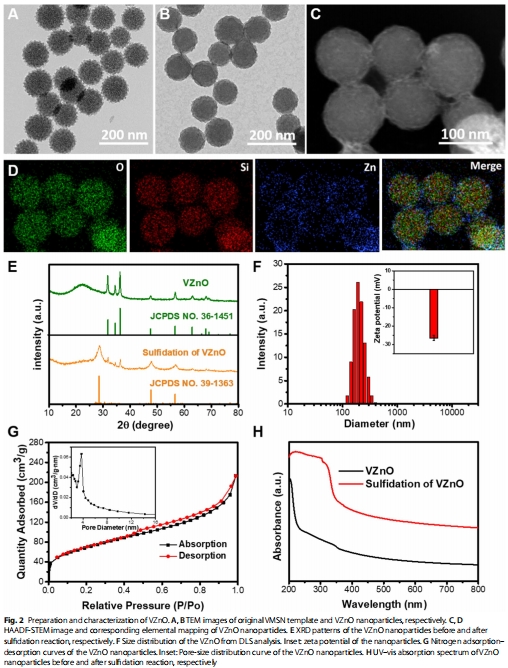
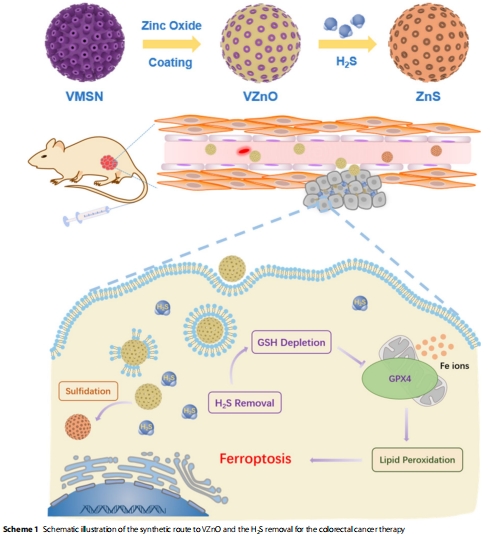
VZnO的構(gòu)建與功能:以病毒樣介孔二氧化硅(VMSN)為載體的氧化鋅納米球(圖2A-D),通過反應(yīng) ZnO+HX2S
ZnS+HX2O高效清除H?S(圖2E,H)。
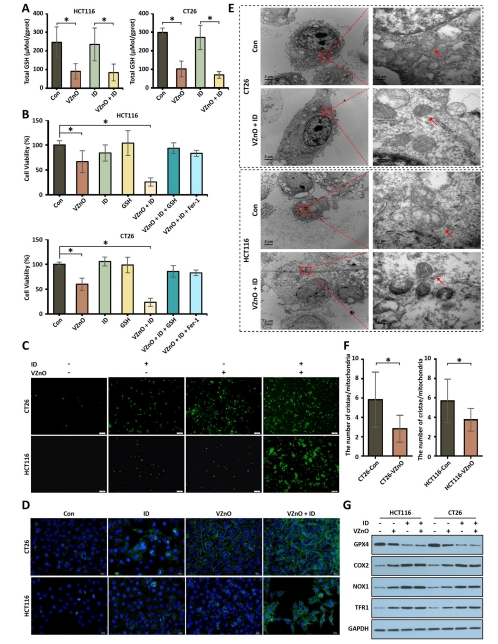
鐵死亡機(jī)制:H?S清除導(dǎo)致谷胱甘肽(GSH)耗竭(圖3A),激活脂質(zhì)過氧化和線粒體損傷(圖3C-E),最終誘導(dǎo)鐵死亡(圖3G)。

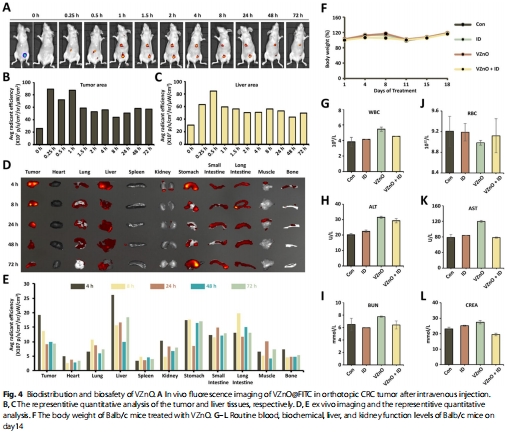
靶向性與安全性:VZnO選擇性殺傷CRC細(xì)胞(CT26/HCT116),對(duì)H?S低表達(dá)的乳腺癌(4T1)無效(圖5J);體內(nèi)實(shí)驗(yàn)顯示低毒性(圖4F-G)。

2. 研究目的
驗(yàn)證H?S在CRC中的特異性高表達(dá)及其促癌作用;
開發(fā)靶向清除H?S的納米平臺(tái)(VZnO);
闡明H?S清除誘導(dǎo)鐵死亡的分子機(jī)制;
評(píng)估VZnO的體內(nèi)靶向性和生物安全性。
3. 研究思路
臨床問題→納米設(shè)計(jì)→機(jī)制驗(yàn)證→體內(nèi)應(yīng)用:
臨床樣本分析:通過Unisense H?S微傳感器檢測(cè)CRC患者組織中H?S濃度(圖1A-F)。
納米平臺(tái)構(gòu)建:合成病毒樣SiO?載體(VMSN),表面負(fù)載ZnO形成VZnO(Scheme 1, 圖2A-D)。
體外機(jī)制驗(yàn)證:
H?S清除導(dǎo)致GSH耗竭(圖3A)和ROS升高(圖3C);
鐵死亡特征:脂質(zhì)過氧化(圖3D)、線粒體嵴消失(圖3E)、GPX4下調(diào)(圖3G)。
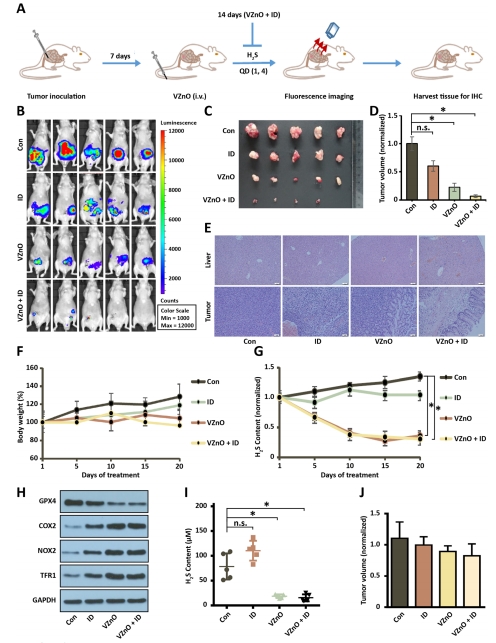
體內(nèi)療效評(píng)估:
靶向富集:VZnO@FITC在CRC原位瘤特異性蓄積(圖4A-E);
抑瘤效果:顯著抑制CT26原位瘤生長(圖5A-D),但對(duì)4T1乳腺癌無效(圖5J)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1)H?S在CRC中的高表達(dá)(圖1)
數(shù)據(jù):
CRC患者組織H?S濃度↑2.5倍(vs. 正常組織,p<0.05)(圖1A);
CRC細(xì)胞(HCT116/CT26)H?S水平顯著高于非CRC細(xì)胞(4T1/SKOV3)(圖1B);
CBS酶(H?S合成關(guān)鍵酶)在CRC中高表達(dá)(圖1D-F)。
意義:確立H?S作為CRC治療靶點(diǎn),為VZnO設(shè)計(jì)提供理論依據(jù)。
(2)VZnO的H?S清除能力(圖2)
數(shù)據(jù):
VZnO與H?S反應(yīng)后,XRD譜中ZnO峰消失,ZnS峰出現(xiàn)(圖2E);
UV-vis顯示反應(yīng)后吸收增強(qiáng)(350 nm)(圖2H)。
意義:證實(shí)VZnO通過化學(xué)轉(zhuǎn)化高效清除H?S,為后續(xù)抑瘤機(jī)制奠定基礎(chǔ)。
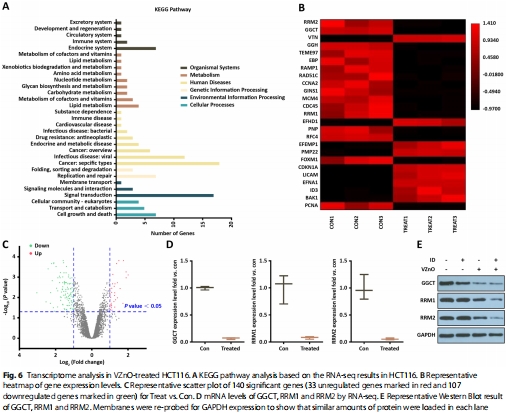
(3)鐵死亡激活(圖3)
數(shù)據(jù):
GSH水平↓40%(HCT116)和↓35%(CT26)(圖3A);
ROS↑2.1倍(DCFH-DA檢測(cè))(圖3C);
脂質(zhì)過氧化↑(C11-BODIPY熒光增強(qiáng))(圖3D);
線粒體嵴斷裂/消失(TEM)(圖3E);
GPX4↓60%,COX2/NOX1/TFR1↑(圖3G)。
意義:首次將H?S清除與鐵死亡關(guān)聯(lián),揭示GSH耗竭是關(guān)鍵樞紐。
(4)體內(nèi)靶向與療效(圖4-5)
數(shù)據(jù):
VZnO@FITC在CRC瘤內(nèi)富集(4h達(dá)峰)(圖4A-C);
VZnO+鐵葡聚糖(ID)使原位瘤體積↓70%(vs. PBS組)(圖5C-D);
腫瘤組織GPX4↓、H?S濃度↓80%(圖5H-I)。
意義:證實(shí)VZnO的CRC靶向性和鐵死亡激活的體內(nèi)可行性。
5. 核心結(jié)論
H?S是CRC特異性靶點(diǎn):臨床樣本及細(xì)胞模型均證實(shí)其高表達(dá)。
VZnO高效清除H?S:通過ZnO+H?S→ZnS反應(yīng)消耗H?S,降低腫瘤內(nèi)H?S濃度。
鐵死亡是核心機(jī)制:H?S清除→GSH耗竭→GPX4失活→脂質(zhì)過氧化累積→鐵死亡。
靶向性與安全性:VZnO選擇性殺傷CRC細(xì)胞,對(duì)正常組織毒性低。
6. 丹麥Unisense電極的研究意義
技術(shù)應(yīng)用與數(shù)據(jù):
功能:采用Unisense H?S微傳感器(Model H?S-MRCh)定量檢測(cè):
臨床樣本:CRC vs. 正常組織H?S濃度(圖1A-C);
細(xì)胞模型:CRC細(xì)胞(HCT116/CT26)vs. 非CRC細(xì)胞(4T1/MCF-10A)H?S水平(圖1B);
體內(nèi)動(dòng)態(tài):治療后腫瘤內(nèi)H?S下降80%(圖5I)。
檢測(cè)原理:安培法(amperometric)結(jié)合微電極技術(shù),直接測(cè)量溶解H?S濃度。
科學(xué)價(jià)值:
高靈敏度與特異性:
微米級(jí)探針(<10 μm)實(shí)現(xiàn)組織微區(qū)H?S定量,避免傳統(tǒng)生化法的樣本破壞。
臨床驗(yàn)證:首次精準(zhǔn)量化人CRC組織H?S梯度(圖1A),確立其作為生物標(biāo)志物。
機(jī)制解析關(guān)鍵:
證實(shí)CBS抑制劑(AOAA)降低H?S后抑制CRC生長(圖1G-I),反向驗(yàn)證H?S的促癌作用;
動(dòng)態(tài)監(jiān)測(cè)VZnO治療后腫瘤H?S持續(xù)下降(圖5G),直接關(guān)聯(lián)療效與H?S清除效率。
轉(zhuǎn)化醫(yī)學(xué)價(jià)值:
為CRC診斷提供潛在工具:H?S濃度可區(qū)分癌/正常組織(AUC>0.9);
指導(dǎo)納米藥物設(shè)計(jì):Unisense數(shù)據(jù)驗(yàn)證VZnO的H?S清除效率(圖2E,H)。
領(lǐng)域貢獻(xiàn):
確立H?S作為CRC治療靶點(diǎn)的臨床證據(jù)鏈(從樣本到機(jī)制);
推動(dòng)微傳感器技術(shù)在腫瘤代謝研究中的應(yīng)用,為精準(zhǔn)納米醫(yī)學(xué)提供數(shù)據(jù)支撐。
機(jī)制示意圖:
CRC微環(huán)境H?S↑ → VZnO靶向富集 → ZnO + H?S → ZnS
→ GSH合成受阻 → GPX4活性↓ → 脂質(zhì)ROS累積
→ 線粒體損傷(嵴斷裂) → 鐵死亡
創(chuàng)新點(diǎn):首次將工業(yè)脫硫材料ZnO轉(zhuǎn)化為腫瘤靶向納米藥物,開辟“代謝清除-鐵死亡”聯(lián)動(dòng)的CRC治療新范式。