熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Low neuronal metabolism during isoflurane-induced burst suppression is related to synaptic inhibition while neurovascular coupling and mitochondrial function remain intact
異氟醚誘導(dǎo)的爆發(fā)抑制期間神經(jīng)元代謝低下與突觸抑制有關(guān),而神經(jīng)血管耦合和線粒體功能
來源:Journal of Cerebral Blood Flow &Metabolism 2021, Vol. 41(10) 2640–2655
1. 摘要核心內(nèi)容
本研究通過體內(nèi)大鼠模型和體外腦片實(shí)驗(yàn),探究異氟醚(Isoflurane)在爆發(fā)抑制(Burst Suppression)麻醉深度下對神經(jīng)代謝的影響。關(guān)鍵發(fā)現(xiàn):
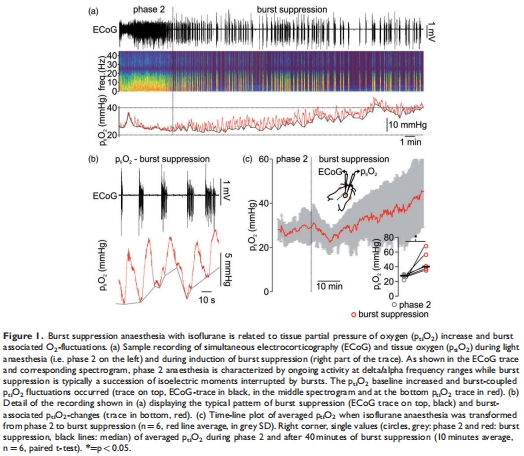
腦組織氧分壓(p??O?):爆發(fā)抑制期p??O?顯著升高(40.2 vs. 27.8 mmHg,p=0.02),伴隨爆發(fā)相關(guān)的局部p??O?波動(圖1)。
腦血流(rCBF):rCBF降低35%(101.0% → 65.0%,p<0.001),但神經(jīng)血管耦合(刺激誘導(dǎo)的rCBF反應(yīng))保持完整(圖2)。


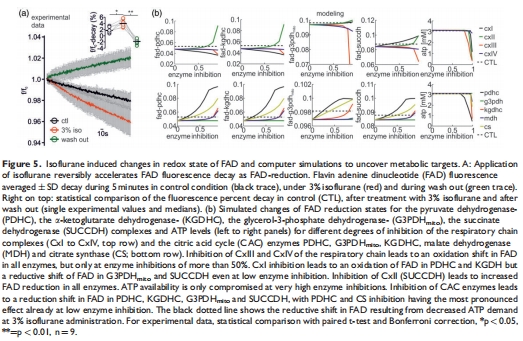
線粒體功能:異氟醚誘導(dǎo)黃素腺嘌呤二核苷酸(FAD)還原性偏移(熒光衰減加速至4.3% vs. 1.7%,p=0.03),但計(jì)算模型預(yù)測其源于突觸抑制而非直接線粒體抑制(圖5)。
對比丙泊酚:異氟醚不直接抑制線粒體復(fù)合物(如丙泊酚抑制復(fù)合物II),其代謝安全性更優(yōu)。
2. 研究目的
明確異氟醚在爆發(fā)抑制麻醉深度下:
是否通過抑制突觸傳遞間接降低腦氧代謝率(CMRO?);
是否直接損害線粒體功能或神經(jīng)血管耦合;
為神經(jīng)保護(hù)性麻醉策略提供理論依據(jù)(如癲癇持續(xù)狀態(tài)、顱腦創(chuàng)傷)。
3. 研究思路
雙模型驗(yàn)證 → 多參數(shù)聯(lián)動分析 → 計(jì)算模型驗(yàn)證:
體內(nèi)模型:
麻醉大鼠(8周齡Wistar)實(shí)時監(jiān)測:ECoG(腦電圖)、p??O?(Unisense微電極)、rCBF(激光多普勒)、血壓(圖1-2)。
爆發(fā)抑制誘導(dǎo):增加異氟醚濃度(1% → 3%),觀察動態(tài)變化。
體外模型:
海馬腦片(CA3區(qū))同步記錄:局部場電位(LFP)、p??O?、FAD熒光(線粒體氧化還原態(tài))、胞外Ca2?/K?(圖3-6)。

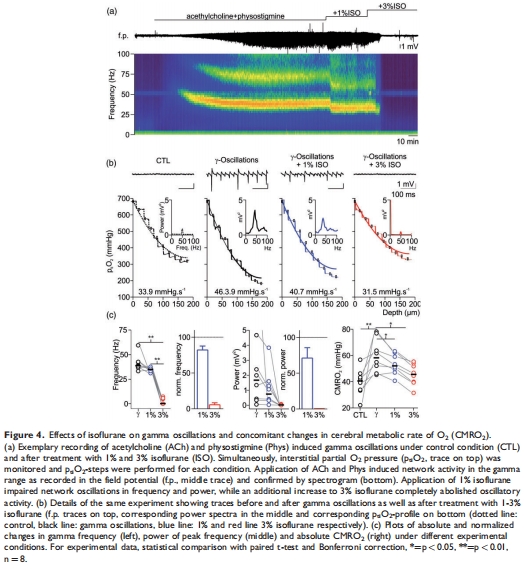

電刺激誘導(dǎo)γ振蕩,分析突觸傳遞與代謝耦合。
計(jì)算模型:
基于實(shí)驗(yàn)數(shù)據(jù)模擬ATP消耗、CMRO?、FAD瞬變,區(qū)分異氟醚的直接/間接效應(yīng)(圖5-6)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1)神經(jīng)血管功能(圖1-2)
數(shù)據(jù):
p??O?升高:爆發(fā)抑制期p??O?↑44%(40.2 vs. 27.8 mmHg),爆發(fā)活動伴局部p??O?波動(↑5 mmHg)(圖1)。
rCBF降低但耦合完整:rCBF↓35%(65.0% vs. 101.0%),但刺激誘導(dǎo)的rCBF反應(yīng)增強(qiáng)(157.4% vs. 140.1%,p=0.03)(圖2)。
意義:異氟醚通過降低代謝需求而非損害血管功能維持腦氧平衡。
(2)突觸抑制與CMRO?(圖3-4)
數(shù)據(jù):
突觸傳遞抑制:3%異氟醚使正交群峰電位(PS)↓89%(-0.26 vs. -2.3 mV),配對脈沖易化(PPR)消失(圖3b)。
CMRO?降低:腦片CMRO?↓17%(31.2 vs. 37.7 mmHg·s?1,p=0.004),γ振蕩幾乎消失(圖4)。
意義:突觸活動抑制是CMRO?下降的主因,減少ATP消耗(模擬預(yù)測↓38%)。
(3)線粒體功能(圖5-6)
數(shù)據(jù):
FAD還原性偏移:3%異氟醚加速FAD熒光衰減(4.3% vs. 1.7%),提示線粒體還原態(tài)增強(qiáng)(圖5a)。
刺激誘導(dǎo)FAD瞬變減弱:氧化峰↓71%(0.6% vs. 2.1%),還原谷↓26%(-1.4% vs. -1.9%)(圖6a-b)。
意義:計(jì)算模型證實(shí)FAD變化由突觸抑制間接引起,排除直接線粒體抑制(圖5b, 6c)。
5. 核心結(jié)論
突觸抑制主導(dǎo)代謝降低:異氟醚通過阻斷突觸傳遞(GABA?受體、Ca2?通道)減少ATP需求,間接降低CMRO?。
線粒體功能完整:無證據(jù)表明異氟醚直接抑制呼吸鏈復(fù)合物(與丙泊酚相反)。
神經(jīng)血管耦合保留:rCBF雖降低,但刺激誘導(dǎo)的血管反應(yīng)增強(qiáng),支持腦氧供需匹配。
臨床意義:異氟醚的代謝安全性優(yōu)于丙泊酚,適用于需深度神經(jīng)保護(hù)的場景(如難治性癲癇)。
6. 丹麥Unisense電極的研究意義
技術(shù)應(yīng)用與數(shù)據(jù):
功能:采用Unisense 10μm Clark型氧電極(圖1, 3)實(shí)時監(jiān)測皮層和海馬p??O?,空間分辨率達(dá)微米級。
關(guān)鍵發(fā)現(xiàn):
捕捉爆發(fā)抑制期p??O?雙相變化:基線升高(40.2 mmHg) + 爆發(fā)相關(guān)波動(↑5 mmHg)(圖1)。
揭示腦片p??O?梯度(圖3a),計(jì)算CMRO?下降(31.2 mmHg·s?1)。
記錄刺激誘導(dǎo)p??O?瞬時下降(Δp??O?:9.9 → 3.4 mmHg),印證突觸活動減少(圖6)。
科學(xué)價(jià)值:
高時空分辨率:
電極直徑僅10μm,可植入特定腦區(qū)(如海馬CA3),避免全腦平均值偏差。
秒級響應(yīng)速度捕捉動態(tài)變化(如爆發(fā)相關(guān)p??O?波動),為神經(jīng)血管耦合提供直接證據(jù)。
機(jī)制解析關(guān)鍵:
證實(shí)p??O?變化與rCBF解耦:rCBF↓35%但p??O?↑44%,指向代謝需求下降的主導(dǎo)作用。
量化刺激誘導(dǎo)氧耗(圖6),明確突觸活動與氧代謝的實(shí)時關(guān)聯(lián)。
轉(zhuǎn)化醫(yī)學(xué)價(jià)值:
為術(shù)中腦氧監(jiān)測提供技術(shù)基準(zhǔn),支持個體化麻醉深度調(diào)控。
推動Unisense電極作為腦氧代謝研究的金標(biāo)準(zhǔn),尤其適用于微循環(huán)及線粒體功能研究。
領(lǐng)域貢獻(xiàn):
確立異氟醚的代謝安全性:通過精準(zhǔn)p??O?監(jiān)測,否定其直接線粒體毒性,為神經(jīng)保護(hù)性麻醉提供依據(jù)。
深化對爆發(fā)抑制機(jī)制的理解:代謝降低源于突觸抑制而非能量危機(jī)。
機(jī)制示意圖:
異氟醚作用通路:
突觸抑制(GABA?/Ca2?通道)
→ ↓突觸傳遞 → ↓ATP消耗
→ ↑ATP/ADP比 → 抑制ATP合酶
→ ↑線粒體還原態(tài)(FAD↓)
→ ↓CMRO?(間接效應(yīng))
對比丙泊酚:直接抑制復(fù)合物II → 線粒體功能障礙。