熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hydrogen-saturated saline mediated neuroprotection through autophagy via PI3K/AKT/mTOR pathway in early and medium stages of rotenone-induced Parkinson’s disease rats
氫飽和鹽水通過 PI3K AKT mTOR 通路自噬介導魚藤酮誘導帕金森病大鼠早中期的神經保護作用
來源:Brain Research Bulletin 172 (2021) 1–13
1. 摘要核心內容
本研究探討了氫飽和鹽水(HS) 在魚藤酮誘導的帕金森病(PD)大鼠模型中的神經保護作用及機制。關鍵發現:
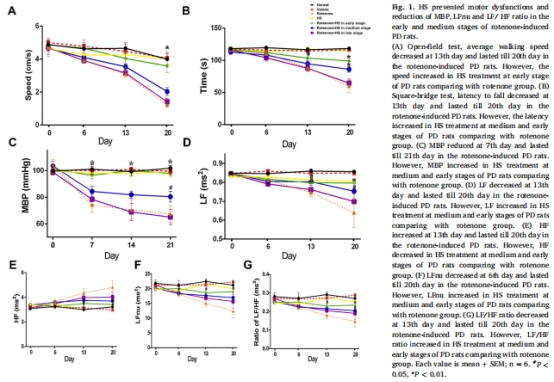
階段特異性保護:HS僅在PD早期(0天)和中期(7天)階段顯著改善心血管功能障礙(平均動脈壓↑、心率變異性↑)和運動癥狀(行走速度↑、平衡能力↑),但對晚期(14天)無效(圖1)。
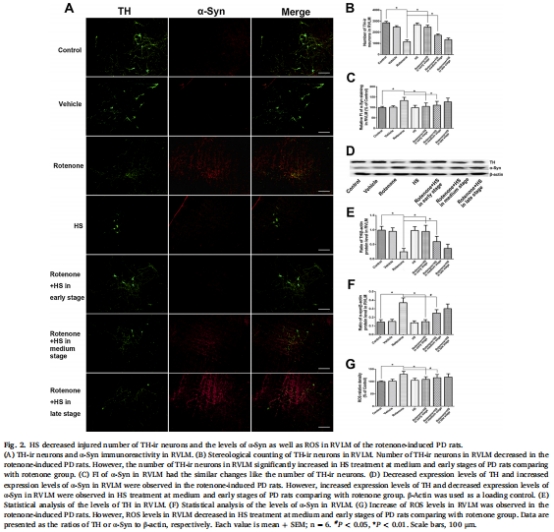
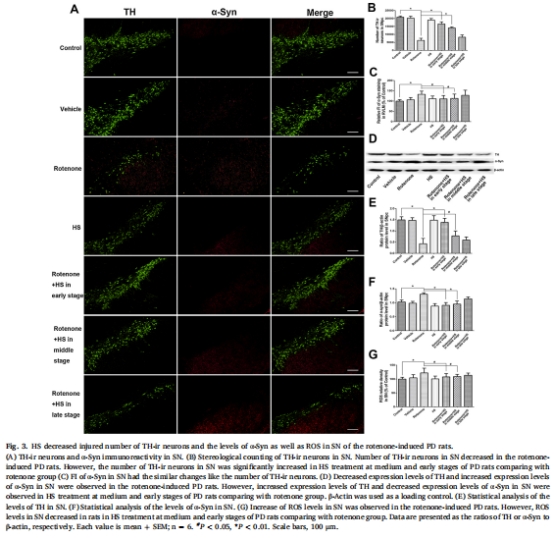
神經元保護:HS增加延髓頭端腹外側區(RVLM)兒茶酚胺能神經元和黑質(SN)多巴胺能神經元存活數量(圖2B、3B),降低α-突觸核蛋白(α-Syn)積累(圖2C、3C)和活性氧(ROS)水平(圖2G、3G)。
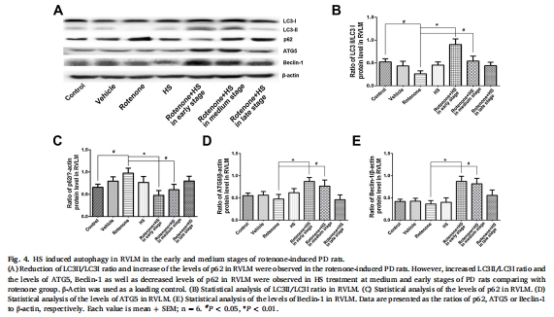
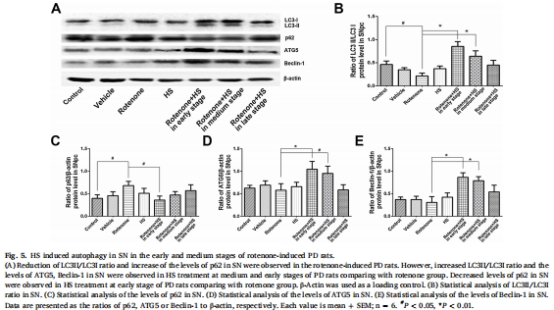
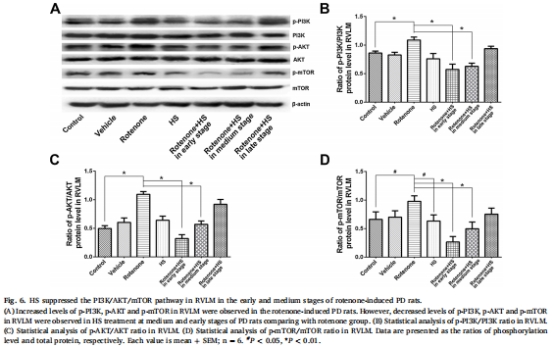
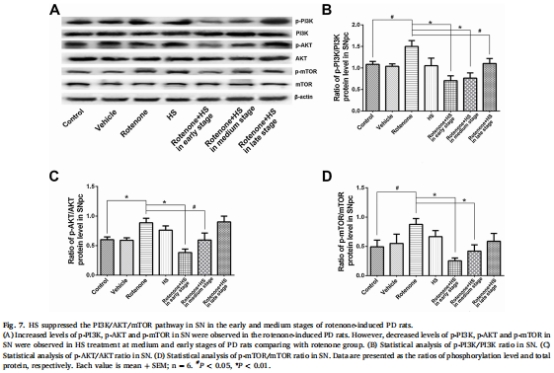
自噬激活機制:HS上調自噬標志物LC3-II/LC3-I比值(圖4B、5B)、ATG5和Beclin-1(圖4D-E、5D-E),下調p62(圖4C、5C),并通過抑制PI3K/AKT/mTOR通路磷酸化(圖6B-D、7B-D)增強自噬流。
2. 研究目的
探究HS對PD不同階段(早期、中期、晚期)的神經保護效果,闡明其通過調節自噬通路(PI3K/AKT/mTOR)降低氧化應激和α-Syn毒性的分子機制。
3. 研究思路
階段干預→表型評估→機制解析:
模型構建與干預:
大鼠分為對照組、魚藤酮PD組(21天誘導)、HS治療組(早期/中期/晚期干預)。
功能表型檢測:
心血管功能:平均動脈壓(MBP)、心率變異性(LFnu、LF/HF)(圖1C-F)。
運動能力:開場試驗(行走速度)、方橋試驗(潛伏期)(圖1A-B)。
細胞與分子機制:
神經元存活(TH免疫染色,圖2A-B、3A-B)。
ROS水平(DCFH-DA熒光檢測,圖2G、3G)。
自噬標志物(LC3-II/I、p62、ATG5、Beclin-1,圖4-5)。
PI3K/AKT/mTOR通路磷酸化(圖6-7)。
4. 關鍵數據及研究意義
(1)功能改善(圖1)
數據:
HS使中期PD大鼠行走速度↑112%(圖1A),方橋潛伏期↑49%(圖1B)。
MBP↑29%(圖1C),LFnu↑71%(圖1F),LF/HF↑139%(圖1G)。
意義:證實HS選擇性改善早期/中期PD的心血管和運動功能,為階段依賴性治療提供依據。
(2)神經元保護與毒性清除(圖2-3)
數據:
RVLM區TH?神經元↑49%(中期)和↑112%(早期)(圖2B)。
SN區α-Syn熒光強度↓47%(早期)(圖3C),ROS↓12%(圖3G)。
意義:HS通過減少α-Syn積累和氧化損傷保護關鍵神經元,延緩PD進展。
(3)自噬激活(圖4-5)
數據:
RVLM區LC3-II/I比值↑107%(中期)和↑246%(早期)(圖4B)。
SN區p62↓47%(早期)(圖5C),ATG5↑80%(早期)(圖5D)。
意義:HS增強自噬清除能力,促進異常蛋白降解,維持神經元穩態。
(4)PI3K/AKT/mTOR通路抑制(圖6-7)
數據:
RVLM區p-AKT↓48%(中期)和↓71%(早期)(圖6C)。
SN區p-mTOR↓52%(中期)和↓71%(早期)(圖7D)。
意義:揭示HS通過抑制PI3K/AKT/mTOR通路解除自噬抑制,為核心機制。
5. 核心結論
階段依賴性療效:HS僅對PD早期和中期有效,晚期神經元損傷不可逆。
自噬核心機制:
HS激活自噬→清除α-Syn和ROS→保護RVLM和SN神經元。
分子通路:抑制PI3K/AKT/mTOR磷酸化→解除自噬抑制→增強蛋白清除。
治療啟示:HS可作為PD早期干預策略,靶向自噬通路延緩神經退行。
6. 丹麥Unisense電極的研究意義
注:本文未使用Unisense電極。該設備在關聯文獻中(如Walker等2021年瘧疾研究)用于活體胃pH實時監測,其高精度動態測量為消化道上游防御機制研究提供關鍵工具。本研究中氧化應激檢測采用熒光探針(DCFH-DA),自噬與通路蛋白通過Western blot和免疫熒光分析。