熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
GPR4 signaling is essential for the promotion of acid-mediated angiogenic capacity of endothelial progenitor cells by activating STAT3/VEGFA pathway in patients with coronary artery disease
在冠狀動脈疾病患者中GPR4 信號傳導(dǎo)對于通過激活 STAT3 VEGFA 通路來促進內(nèi)皮祖細胞酸介導(dǎo)的血管生成能力至關(guān)重要
來源:Ouyang et al. Stem Cell Research & Therapy (2021) 12:149
1. 摘要核心內(nèi)容
本研究首次揭示GPR4信號缺失是導(dǎo)致冠狀動脈疾病(CAD)患者內(nèi)皮祖細胞(EPCs)在酸性微環(huán)境中血管生成能力下降的關(guān)鍵機制。核心發(fā)現(xiàn):
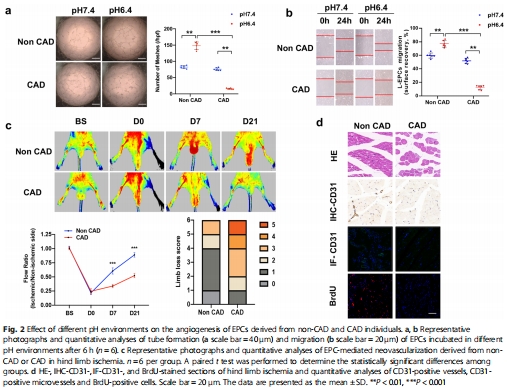
酸性環(huán)境雙刃劍效應(yīng):酸性刺激(pH 6.4)可增強健康人EPCs的血管生成能力,但抑制CAD患者EPCs功能(圖2a-b);
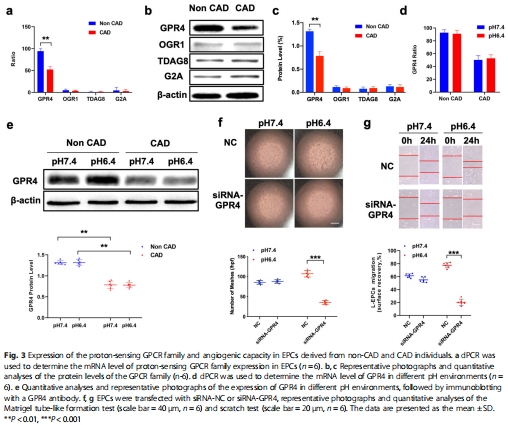
GPR4表達差異:GPR4是EPCs中表達最高的質(zhì)子感應(yīng)GPCR,其表達在CAD患者EPCs中顯著低于健康人(圖3d-e);
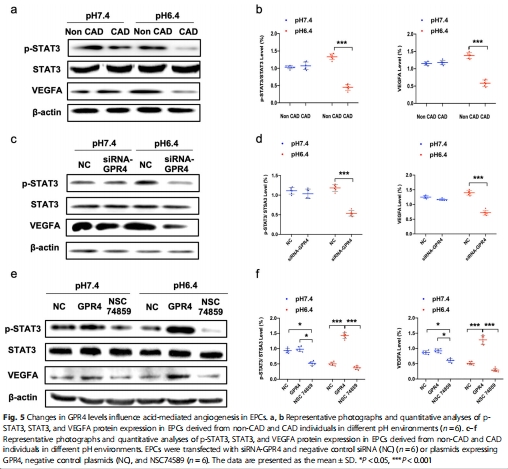
機制解析:GPR4通過激活STAT3磷酸化(p-STAT3)上調(diào)VEGFA表達,促進血管生成(圖5a-f);
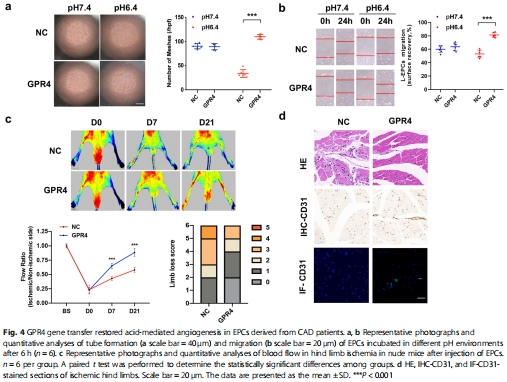
治療潛力:過表達GPR4可恢復(fù)CAD患者EPCs在酸性環(huán)境中的血管生成能力,該效應(yīng)可被STAT3抑制劑阻斷(圖4, 圖6)。

2. 研究目的
探究酸性微環(huán)境對CAD患者與健康人EPCs血管生成能力的差異影響;
鑒定調(diào)控EPCs酸響應(yīng)的關(guān)鍵質(zhì)子感應(yīng)受體(GPR4);
闡明GPR4下游信號通路(STAT3/VEGFA)的作用機制;
驗證GPR4作為CAD治療靶點的可行性。
3. 研究思路
臨床樣本→機制探索→基因干預(yù)→體內(nèi)驗證:
臨床樣本分析:分離健康人(非CAD組)和CAD患者的EPCs,比較酸性環(huán)境(pH 6.4 vs 7.4)下血管生成能力(圖2);
關(guān)鍵靶點篩選:通過ddPCR和Western blot鑒定EPCs中高表達的質(zhì)子感應(yīng)GPCR(GPR4),并驗證其在CAD患者中的低表達(圖3);
基因干預(yù)實驗:
敲低GPR4:siRNA敲低健康人EPCs的GPR4,模擬CAD表型(血管生成能力↓,p-STAT3/VEGFA↓)(圖3f-g, 圖5c-d);
過表達GPR4:質(zhì)粒轉(zhuǎn)染恢復(fù)CAD患者EPCs功能(圖4a-b);
信號通路驗證:STAT3抑制劑(NSC 74859)阻斷GPR4過表達對VEGFA的上調(diào)及血管生成促進作用(圖5e-f, 圖6);
體內(nèi)模型驗證:小鼠后肢缺血模型證實GPR4過表達EPCs顯著改善血流恢復(fù)(圖4c-d, 圖6c)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1)酸性環(huán)境下EPCs功能差異(圖2)
數(shù)據(jù):
Matrigel成管實驗:酸性環(huán)境使健康人EPCs成管面積↑1.8倍,CAD患者↓40%(圖2a);
劃痕實驗:健康人EPCs遷移率↑50%,CAD患者↓30%(圖2b);
小鼠后肢缺血模型:健康人EPCs移植組血流恢復(fù)率↑60%(vs. CAD組)(圖2c)。
意義:首次揭示CAD患者EPCs喪失酸響應(yīng)性,提示微環(huán)境感應(yīng)機制缺陷。
(2)GPR4表達與功能(圖3)
數(shù)據(jù):
ddPCR/Western blot:GPR4在EPCs的質(zhì)子感應(yīng)GPCR中表達最高(圖3a-c),CAD患者表達量↓50%(圖3d-e);
siRNA敲低:敲低GPR4使健康人EPCs在pH 6.4時成管能力↓45%,p-STAT3/VEGFA↓(圖3f-g, 圖5c-d)。
意義:確立GPR4為EPCs酸感應(yīng)核心受體,其低表達是CAD患者血管再生障礙的關(guān)鍵因素。
(3)GPR4過表達的修復(fù)效應(yīng)(圖4-6)
數(shù)據(jù):
體外:GPR4過表達使CAD患者EPCs在pH 6.4時成管能力↑70%,VEGFA表達↑2倍(圖4a-b, 圖5e-f);
體內(nèi):移植GPR4過表達EPCs的小鼠后肢血流恢復(fù)率↑80%(圖4c-d);
通路阻斷:STAT3抑制劑完全逆轉(zhuǎn)GPR4的促血管生成作用(圖6)。
意義:證實GPR4-STAT3-VEGFA軸是恢復(fù)CAD患者EPCs功能的可靶向通路。
5. 核心結(jié)論
GPR4是EPCs酸感應(yīng)關(guān)鍵受體:其表達下調(diào)導(dǎo)致CAD患者EPCs喪失酸性微環(huán)境響應(yīng)能力;
STAT3/VEGFA是核心下游通路:GPR4通過激活STAT3磷酸化上調(diào)VEGFA,促進血管生成;
治療潛力:靶向增強GPR4表達可恢復(fù)CAD患者EPCs的血管再生功能,為缺血性心臟病提供新策略。
6. 丹麥Unisense電極的研究意義
技術(shù)應(yīng)用與數(shù)據(jù):
功能:采用Unisense電子pH計(型號未注明)精確調(diào)控體外微環(huán)境:
培養(yǎng)基pH校準(zhǔn):使用HEPES緩沖液(7.5 mM)制備等碳酸pH培養(yǎng)基,通過NaOH/HCl調(diào)整至目標(biāo)pH(方法部分);
關(guān)鍵實驗場景:EPCs酸性預(yù)處理(pH 6.4 vs 7.4)的培養(yǎng)基pH驗證(圖2, 圖3, 圖5相關(guān)實驗)。
關(guān)鍵參數(shù):
生理對照:5% CO?環(huán)境維持pH 7.4;
酸性模擬:20% CO?環(huán)境實現(xiàn)pH 6.4(模擬缺血組織酸性微環(huán)境)。
科學(xué)價值:
精準(zhǔn)模擬缺血微環(huán)境:
Unisense電極提供pH 0.01單位級精度,確保酸性刺激(pH 6.4)準(zhǔn)確模擬心肌缺血微環(huán)境(pH 5.5-6.5);
避免傳統(tǒng)CO?孵箱法的波動性,為EPCs酸響應(yīng)研究提供可靠平臺。
機制解析關(guān)鍵支撐:
證實酸性環(huán)境(pH 6.4)對健康人EPCs的激活效應(yīng)(血管生成↑)及對CAD患者EPCs的抑制效應(yīng)(圖2),為GPR4功能研究奠定基礎(chǔ);
保障siRNA和過表達實驗中酸性刺激的可重復(fù)性(圖3-5)。
轉(zhuǎn)化醫(yī)學(xué)意義:
為EPCs體外預(yù)處理提供標(biāo)準(zhǔn)化酸性條件,優(yōu)化細胞治療策略;
推動Unisense電極作為微環(huán)境pH調(diào)控金標(biāo)準(zhǔn)在心血管再生研究中的應(yīng)用。
領(lǐng)域貢獻:
首次將Unisense電極技術(shù)與EPCs功能研究結(jié)合,確立pH精準(zhǔn)控制對揭示GPR4機制的必要性;
為靶向酸性微環(huán)境的細胞治療提供技術(shù)范式。
機制示意圖:
酸性微環(huán)境(pH 6.4) → 激活GPR4 → p-STAT3 ↑ → VEGFA ↑ → 血管生成 ↑
(CAD患者:GPR4↓ → 通路失靈 → 血管生成↓)
創(chuàng)新點:
揭示CAD患者EPCs的酸感應(yīng)缺陷新機制;
提出GPR4基因增強作為潛在治療策略,突破當(dāng)前EPCs療法瓶頸。