熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hydrogen Sulfide Is a Regulator of Hemoglobin Oxygen-Carrying Capacity via Controlling 2,3-BPG Production in Erythrocytes
硫化氫通過控制紅細胞中 2,3-BPG 的產生來調節血紅蛋白攜氧能力
來源:Oxidative Medicine and Cellular Longevity Volume 2021, Article ID 8877691, 16 pages
1. 摘要核心內容
本研究首次揭示內源性硫化氫(H?S) 是紅細胞內 2,3-二磷酸甘油酸(2,3-BPG) 產生的關鍵抑制因子,通過調節血紅蛋白(Hb)與細胞膜的錨定狀態,控制雙磷酸甘油酸變位酶(BPGM)的亞細胞定位,從而影響Hb-O?結合親和力。主要發現:
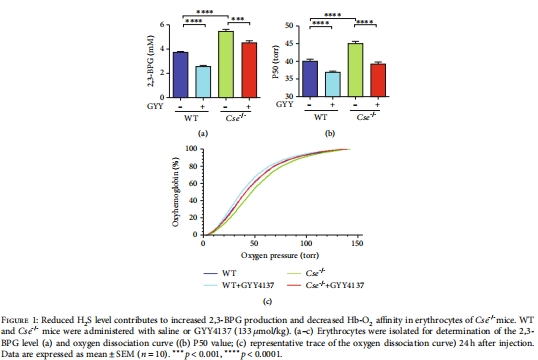
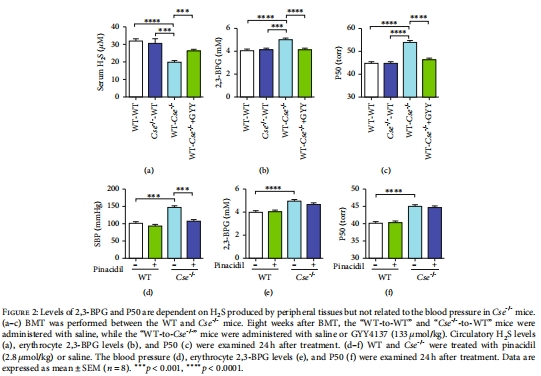
H?S缺失導致2,3-BPG升高:胱硫醚-γ-裂解酶(CSE)基因敲除(Cse?/?)小鼠紅細胞中2,3-BPG水平顯著增加,50%氧飽和度(P50)值升高(圖1a-c)。
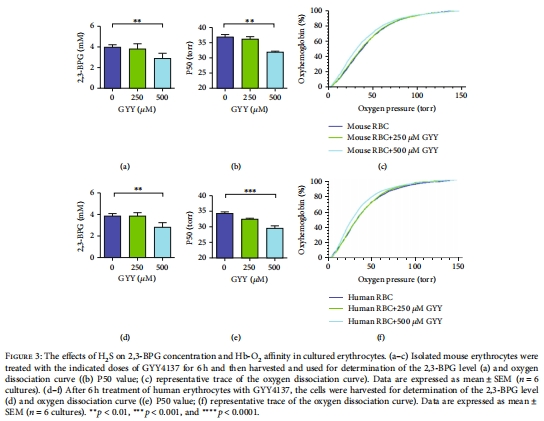
H?S直接作用于紅細胞:體外實驗證實H?S供體GYY4137可降低2,3-BPG并增強Hb-O?親和力(圖3)。
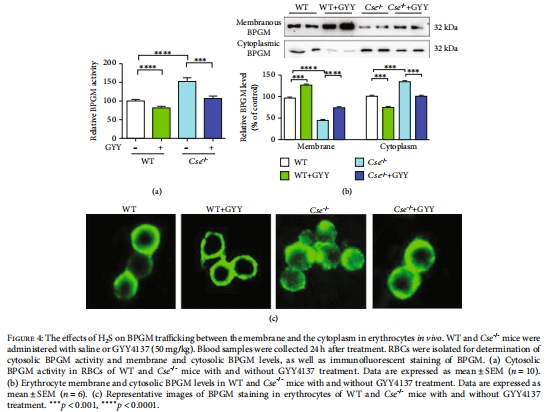
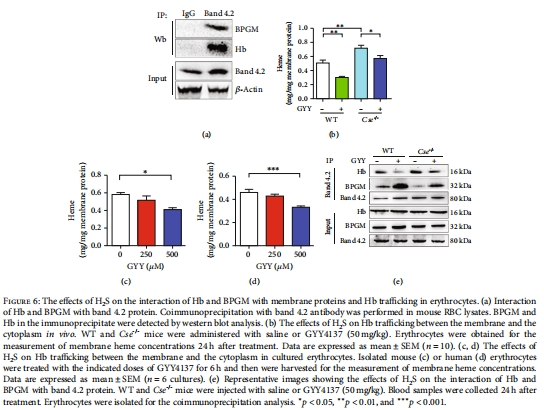
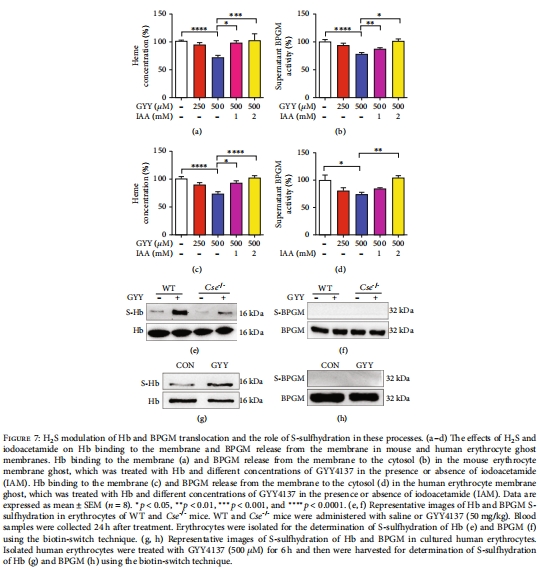
分子機制:H?S通過促進Hb從膜釋放至胞質,增強BPGM膜錨定(圖4-6),該過程與Hb的S-硫磺化修飾(Cys104位點)相關(圖7)。
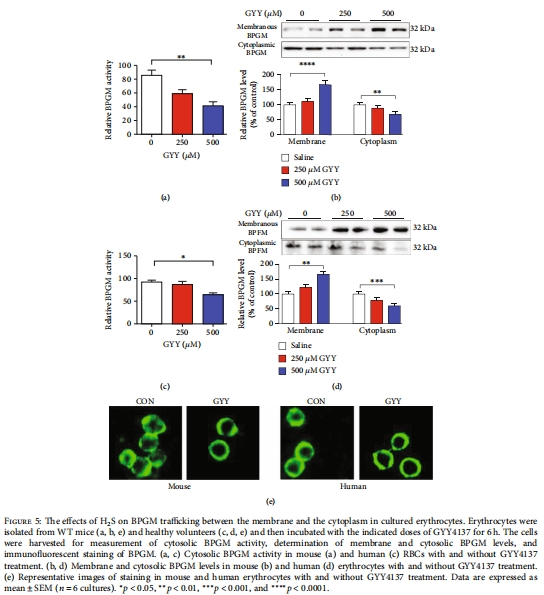
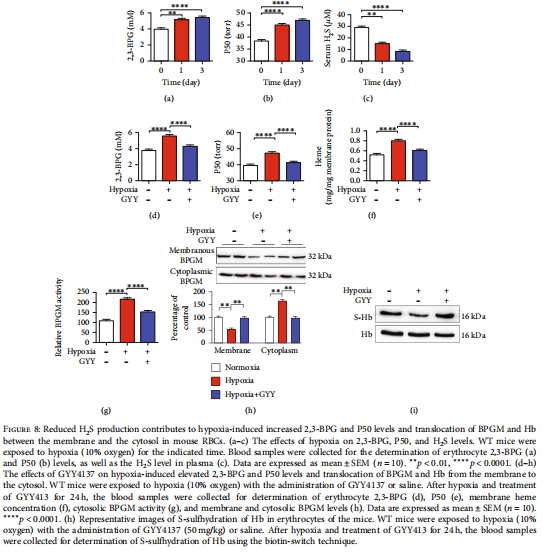
缺氧適應性:缺氧降低循環H?S水平,增加2,3-BPG,而GYY4137可逆轉此效應(圖8)。
2. 研究目的
探究H?S是否及如何調節紅細胞內2,3-BPG代謝和Hb-O?親和力,特別是在缺氧適應中的作用,為紅細胞氧運輸調控提供新機制。
3. 研究思路
基因模型→代謝組學→機制解析→缺氧驗證:
動物模型:
比較Cse?/?小鼠與野生型(WT)紅細胞代謝差異(代謝組學分析,圖1)。
骨髓移植實驗區分H?S來源(外周組織 vs. 紅細胞自身,圖2)。
體外驗證:
人/鼠紅細胞培養體系,添加H?S供體(GYY4137)或抑制劑(碘乙酰胺)。
檢測2,3-BPG、P50、BPGM亞細胞定位(圖3-5)。
分子機制:
免疫共沉淀(Co-IP)和質譜分析Hb與BPGM的相互作用(圖6)。
S-硫磺化修飾檢測(生物素轉換法,圖7)。
缺氧模型:
10% O?處理小鼠,監測H?S水平與2,3-BPG動態變化(圖8)。
4. 關鍵數據及研究意義
(1)H?S缺失增加2,3-BPG與P50(圖1)
數據:Cse?/?小鼠紅細胞2,3-BPG升高40%,P50增加4-6 mmHg(圖1a-c)。
意義:首次證明內源性H?S是2,3-BPG的生理性抑制因子,維持正常Hb-O?親和力。
(2)H?S調控BPGM膜-胞質轉運(圖4-5)
數據:
Cse?/?小鼠胞質BPGM活性升高2倍,膜錨定BPGM減少(圖4a-b)。
GYY4137處理逆轉BPGM膜定位(免疫熒光,圖4c)。
意義:揭示H?S通過控制BPGM亞細胞分布調節2,3-BPG合成,突破傳統代謝酶活性調控認知。
(3)Hb S-硫磺化修飾的關鍵作用(圖7)
數據:
MS鑒定Hb α鏈Cys104為S-硫磺化位點(圖7e-g)。
H?S缺失降低修飾水平,增加Hb膜錨定(膜血紅素含量升高,圖6b-d)。
意義:提出 H?S-Hb-BPGM軸新機制——S-硫磺化促進Hb胞質游離,減少與BPGM競爭性膜結合。
(4)缺氧通過H?S下調適應氧運輸(圖8)
數據:缺氧24小時,循環H?S下降50%,2,3-BPG升高35%,P50增加15%(圖8a-c)。
意義:闡明缺氧適應性新通路——低H?S→高2,3-BPG→Hb氧親和力降低→優化組織氧釋放。
5. 核心結論
H?S是紅細胞氧親和力核心調節因子:通過抑制2,3-BPG合成維持正常Hb-O?結合。
分子機制依賴Hb-BPGM空間競爭:H?S通過S-硫磺化修飾(Cys104)促進Hb胞質游離,增強BPGM膜錨定,抑制2,3-BPG生成。
缺氧適應性關鍵環節:缺氧降低H?S水平,解除對2,3-BPG的抑制,提升氧釋放能力。
轉化潛力:H?S供體(如GYY4137)可干預缺氧相關病理狀態。
6. 丹麥Unisense電極的研究意義
技術原理與優勢:
微呼吸傳感器(H?S-MRCh):實時監測H?S生成動力學(方法2.11)。
高靈敏度與實時性:檢測限達微摩爾級,動態追蹤H?S生成速率(圖S2)。
關鍵科學貢獻:
量化紅細胞H?S生成能力:
直接證實小鼠紅細胞存在CSE依賴性H?S合成(Cse?/?小鼠生成率降低60%,圖S2)。
發現人紅細胞H?S生成速率與2,3-BPG負相關(圖3d-f)。
揭示缺氧對H?S代謝的即時影響:
Unisense動態曲線顯示:缺氧1小時內H?S生成速率下降40%,為"缺氧→H?S↓→2,3-BPG↑"鏈條提供時間分辨證據(圖8c)。
解析H?S供體藥效動力學:
GYY4137處理后H?S生成速率緩升,持續>6小時(圖3a),解釋其長效調控2,3-BPG的機制。
領域突破性價值:
克服傳統終點法(亞甲基藍法)的低通量局限,實現活細胞H?S代謝實時監測;
為氣體信號分子研究提供動態量化工具,推動紅細胞代謝調控向實時化、精準化發展。