熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Hydrogen enriched saline alleviates morphine tolerance via inhibiting neuroinflammation, GLT-1, GS nitration and NMDA receptor trafficking and functioning in the spinal cord of rats
富氫鹽水通過(guò)抑制大鼠脊髓中的神經(jīng)炎癥、GLT-1、GS 硝化和 -NMDA 受體運(yùn)輸和功能來(lái)減輕嗎啡耐受
來(lái)源:Neuroscience Letters 755 (2021) 135847
1. 摘要核心內(nèi)容
本研究揭示富氫鹽水(HS)緩解嗎啡耐受的分子機(jī)制:
嗎啡耐受模型:大鼠鞘內(nèi)注射嗎啡(10 μg/次,2次/天×5天)誘導(dǎo)耐受,表現(xiàn)為甩尾潛伏期(TFL)、機(jī)械痛閾(PWT)、熱痛閾(PWL)下降(圖1)。
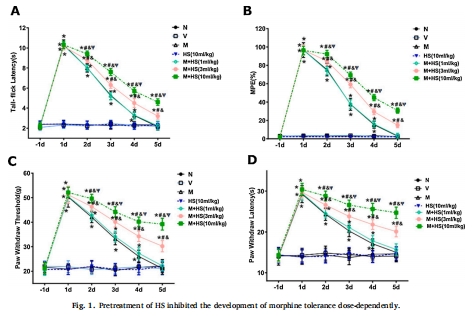
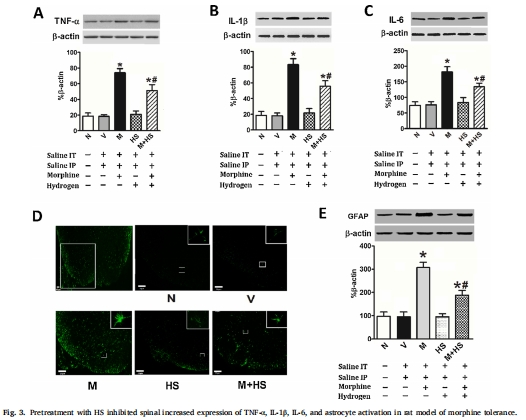
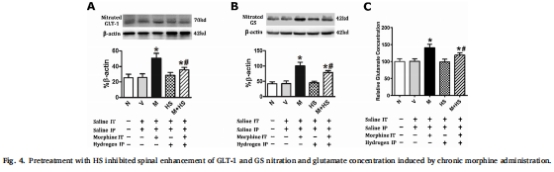
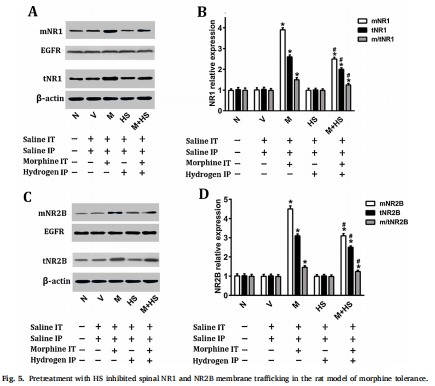
HS干預(yù)效果:腹腔注射HS(1/3/10 mL/kg)劑量依賴性抑制耐受(圖1),降低脊髓背角炎癥因子(TNF-α、IL-1β、IL-6)、星形膠質(zhì)細(xì)胞活化標(biāo)志物GFAP(圖3),減少谷氨酸轉(zhuǎn)運(yùn)體GLT-1和谷氨酰胺合成酶(GS)的硝化(圖4),并抑制NMDA受體NR1/NR2B亞基膜轉(zhuǎn)運(yùn)(圖5)。
核心結(jié)論:HS通過(guò)抑制神經(jīng)炎癥、GLT-1/GS硝化、NMDA受體功能異常,維持谷氨酸穩(wěn)態(tài),從而緩解嗎啡耐受(圖7)。
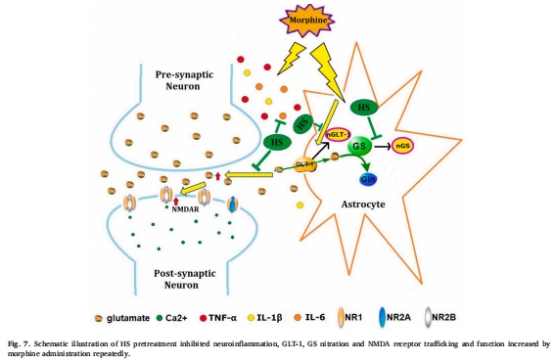
2. 研究目的
探究HS能否通過(guò)調(diào)控以下通路緩解嗎啡耐受:
神經(jīng)炎癥(膠質(zhì)細(xì)胞活化、炎癥因子釋放);
谷氨酸轉(zhuǎn)運(yùn)體功能(GLT-1/GS硝化);
NMDA受體表達(dá)與膜轉(zhuǎn)運(yùn)。
3. 研究思路
多維度驗(yàn)證機(jī)制:
動(dòng)物模型:SD大鼠鞘內(nèi)置管,嗎啡注射誘導(dǎo)耐受(n=8/組),HS干預(yù)組于嗎啡注射前腹腔給予HS。
行為學(xué)檢測(cè):
痛閾評(píng)估:TFL(熱水甩尾)、PWT(von Frey纖維絲)、PWL(熱板實(shí)驗(yàn))(圖1)。
分子機(jī)制分析:
炎癥指標(biāo):Western blot檢測(cè)TNF-α、IL-1β、IL-6;免疫熒光/WB測(cè)GFAP(星形膠質(zhì)細(xì)胞活化)(圖3)。
谷氨酸系統(tǒng):免疫沉淀檢測(cè)GLT-1/GS硝化;比色法測(cè)脊髓谷氨酸濃度(圖4)。
NMDA受體:WB檢測(cè)膜/總NR1、NR2B表達(dá)(圖5)。
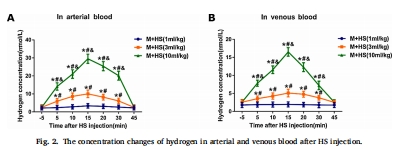
藥代動(dòng)力學(xué):Unisense電極實(shí)時(shí)監(jiān)測(cè)血?dú)錆舛葎?dòng)態(tài)(圖2)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1)行為學(xué)數(shù)據(jù)(圖1)
嗎啡耐受:第5天TFL、PWT、PWL顯著↓(vs. 基線,*P<0.01)。
HS作用:10 mL/kg HS使痛閾恢復(fù)至近基線水平(#P<0.01 vs. 嗎啡組)。
意義:首次證實(shí)HS劑量依賴性緩解嗎啡耐受,且單用HS不影響正常痛閾。
(2)分子機(jī)制數(shù)據(jù)
神經(jīng)炎癥(圖3):
嗎啡組TNF-α、IL-1β、IL-6↑2-3倍,GFAP↑1.8倍(*P<0.01)。
HS(10 mL/kg)顯著抑制炎癥因子及GFAP表達(dá)(#P<0.01)。
意義:HS通過(guò)抑制膠質(zhì)細(xì)胞活化及炎癥因子釋放阻斷耐受。
谷氨酸系統(tǒng)(圖4):
嗎啡誘導(dǎo)GLT-1/GS硝化↑2.5倍,脊髓谷氨酸濃度↑80%(*P<0.01)。
HS減少硝化水平,降低谷氨酸濃度至正常(#P<0.01)。
意義:HS保護(hù)谷氨酸轉(zhuǎn)運(yùn)體功能,維持突觸間隙谷氨酸穩(wěn)態(tài)。
NMDA受體(圖5):
嗎啡組膜NR1/NR2B↑1.5倍(*P<0.01),提示受體膜轉(zhuǎn)運(yùn)增強(qiáng)。
HS抑制NR1/NR2B膜表達(dá)及總表達(dá)(#P<0.01)。
意義:HS阻斷NMDA受體過(guò)度活化,減輕中樞敏化。
(3)功能驗(yàn)證實(shí)驗(yàn)(圖6)
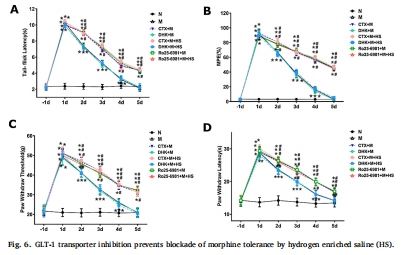
GLT-1抑制劑(DHK):取消HS的耐受緩解作用 → GLT-1功能是關(guān)鍵靶點(diǎn)。
NR2B拮抗劑(Ro25-6981):與HS聯(lián)用無(wú)協(xié)同效應(yīng) → HS通過(guò)抑制NR2B轉(zhuǎn)運(yùn)起效。
5. 核心結(jié)論
HS多靶點(diǎn)作用機(jī)制:
抑制神經(jīng)炎癥(TNF-α↓、IL-1β↓、IL-6↓、GFAP↓);
減少GLT-1/GS硝化,維持谷氨酸轉(zhuǎn)運(yùn)功能;
阻斷NMDA受體NR1/NR2B亞基膜轉(zhuǎn)運(yùn),降低受體活性。
臨床意義:HS可作為一種安全輔助策略(無(wú)單用副作用),延緩嗎啡耐受發(fā)展。
6. 丹麥Unisense電極(氫微傳感器)的研究意義
技術(shù)原理與優(yōu)勢(shì):
安培法實(shí)時(shí)監(jiān)測(cè):氫分子在電極表面氧化產(chǎn)生電流信號(hào) → μmol/L級(jí)靈敏度 + 分鐘級(jí)時(shí)間分辨率(方法2.7)。
雙血管同步檢測(cè):動(dòng)脈/靜脈血?dú)錆舛葎?dòng)態(tài)對(duì)比(圖2)。
關(guān)鍵發(fā)現(xiàn)與科學(xué)價(jià)值:
藥代動(dòng)力學(xué)特征(圖2):
達(dá)峰時(shí)間:HS腹腔注射后15分鐘達(dá)血藥峰值(動(dòng)脈血濃度最高)。
清除速率:45分鐘回落至基線 → 指導(dǎo)給藥時(shí)間窗設(shè)計(jì)(需在嗎啡前10-15分鐘注射)。
劑量相關(guān)性:10 mL/kg HS的血?dú)錆舛蕊@著高于1/3 mL/kg(&P<0.01),解釋其最優(yōu)療效。
機(jī)制關(guān)聯(lián)證據(jù):
"動(dòng)脈血?dú)錆舛雀哂陟o脈血(圖2A vs. 2B),表明氫快速進(jìn)入組織發(fā)揮作用,與后續(xù)抗炎/抗氧化效應(yīng)時(shí)序吻合。"
技術(shù)不可替代性:
突破傳統(tǒng)終點(diǎn)檢測(cè)局限 → 實(shí)時(shí)量化氫生物利用度;
為HS的劑量?jī)?yōu)化和給藥方案提供直接依據(jù)(如:選擇10 mL/kg劑量因血?dú)錆舛茸罡撸?