熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Endogenous Hydrogen Sulfide Is an Important Factor in Maintaining Arterial Oxygen Saturation
內源性硫化氫是維持動脈血氧飽和度的重要因素
來源:Frontiers in Pharmacology May 2021 | Volume 12 | Article 677110
1. 摘要核心內容
本研究首次揭示內源性硫化氫(H?S) 是維持動脈血氧飽和度(SaO?) 的關鍵因子。通過胱硫醚-γ-裂解酶(CSE)基因敲除(Cse?/?)小鼠模型發現:
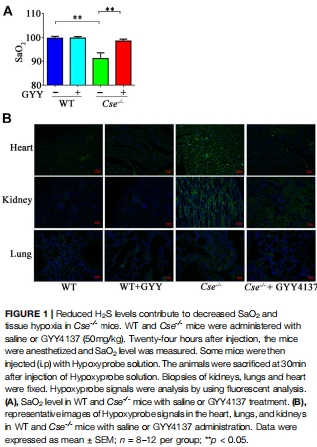
SaO?顯著降低:Cse?/?小鼠SaO?降至90.48%(野生型WT:96-100%),伴心腎組織輕度缺氧(圖1A-B)。
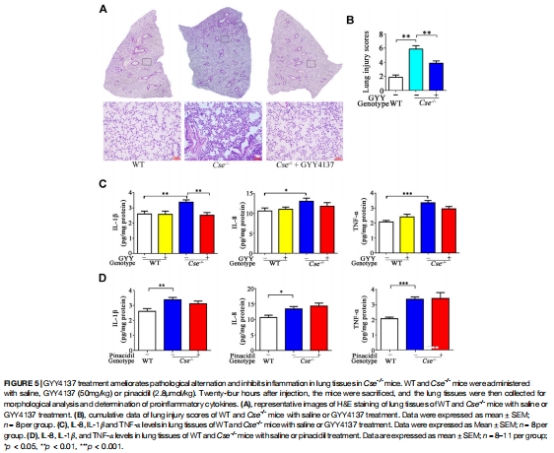
肺部損傷是主因:肺泡壁增厚、間質水腫、白細胞浸潤(圖5A),炎癥因子(IL-8、IL-1β、TNF-α)和氧化應激(MDA↑、SOD↓)顯著升高(圖5C, 6B)。
H?S供體逆轉損傷:GYY4137治療提升SaO?,減輕肺部病理改變(圖5A-B),抑制炎癥與氧化應激(圖5C, 6B)。
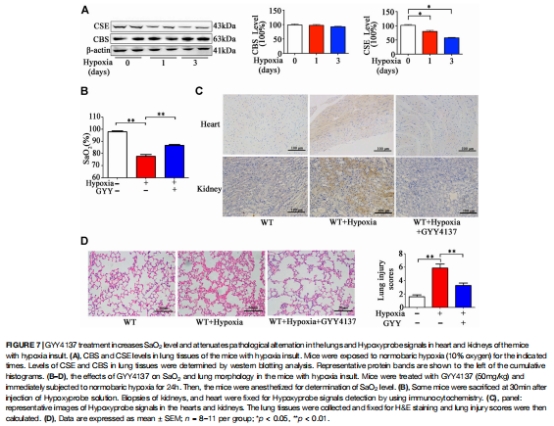
缺氧模型驗證:缺氧降低肺CSE表達(圖7A),GYY4137提升SaO?并緩解缺氧性肺損傷(圖7B-D)。
2. 研究目的
探究內源性H?S是否通過調節肺部氧化應激與炎癥維持正常SaO?,為缺氧相關肺疾病提供治療靶點。
3. 研究思路
基因缺陷→表型解析→機制驗證→缺氧拓展:
模型構建:
對比Cse?/?與WT小鼠SaO?(圖1A)、組織缺氧(Hypoxyprobe檢測,圖1B)。
排除次要因素:
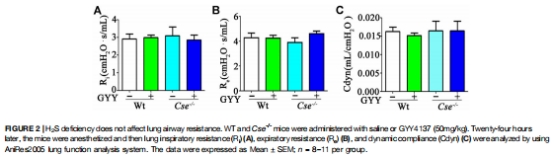
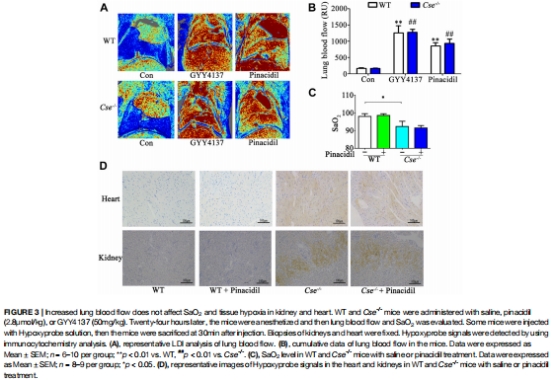
肺氣道阻力(Ri, Re, Cdyn)無差異(圖2A-C);肺血流灌注增加不影響SaO?(圖3)。
聚焦核心機制:
肺組織學與炎癥/氧化指標檢測(圖5-6);H?S供體(GYY4137)干預效果。
缺氧模型驗證:
10% O?處理小鼠,評估H?S對缺氧性SaO?下降的挽救作用(圖7-8)。

4. 關鍵數據及研究意義
(1)SaO?降低與組織缺氧(圖1)
數據:Cse?/?小鼠SaO?↓5.5%,心腎組織Hypoxyprobe信號↑(圖1A-B)。
意義:首次證實內源性H?S缺失直接導致系統性缺氧。
(2)肺部損傷與炎癥(圖5)
數據:
肺泡壁增厚、間質水腫、白細胞浸潤(H&E染色,圖5A);
IL-8/IL-1β/TNF-α↑2-3倍(圖5C)。
意義:揭示肺部結構性損傷是SaO?降低的直接原因。
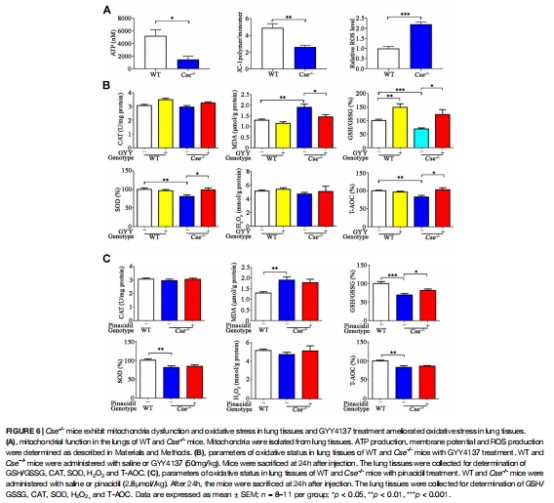
(3)氧化應激與線粒體功能障礙(圖6)
數據:
MDA↑40%,SOD活性↓30%,線粒體ATP↓50%(圖6A-B);
線粒體膜電位↓,ROS↑(圖6A)。
意義:闡明H?S通過維持線粒體功能-氧化平衡軸保護肺組織。
(4)缺氧模型的救治效應(圖7-8)
數據:
缺氧24小時:肺CSE表達↓60%(圖7A),SaO?↓8%(圖7B);
GYY4137恢復SaO?,降低炎癥因子(IL-1β↓50%,圖8A)及氧化損傷(MDA↓35%,圖8B)。
意義:驗證H?S補充可對抗缺氧性肺損傷,具臨床轉化潛力。
5. 核心結論
H?S是SaO?的生理性調節因子:CSE缺失導致肺結構損傷,降低氧合效率。
核心機制為抗氧化與抗炎:
H?S維持線粒體功能(ATP生成、膜電位),抑制ROS積累;
抑制NF-κB炎癥通路,降低IL-8/IL-1β/TNF-α釋放。
缺氧適應性關鍵靶點:缺氧下調肺CSE表達,補充H?S可逆轉SaO?下降。
治療意義:H?S供體(如GYY4137)是潛在抗缺氧肺損傷藥物。
6. 丹麥Unisense電極的研究意義
技術原理與優勢:
微型H?S呼吸傳感器(H?S-MRCh):實時監測組織H?S生成動力學(方法2.6);
高靈敏度與抗干擾設計:氮氣除氧環境防止H?S自發氧化,檢測限達微摩爾級。
關鍵科學貢獻:
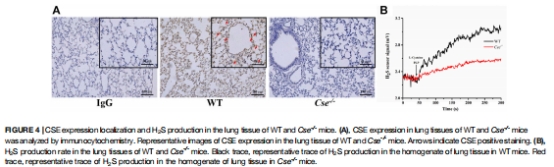
定量肺組織H?S合成能力:
Unisense動態曲線顯示:Cse?/?小鼠肺組織H?S生成速率↓70%(圖4B),直接關聯CSE蛋白缺失(圖4A)。
揭示缺氧對H?S代謝的即時影響:
缺氧24小時:肺H?S生成速率↓50%(圖7A),為"缺氧→CSE↓→H?S↓→SaO?↓"鏈條提供動態證據。
解析H?S供體藥效基礎:
GYY4137處理后肺H?S生成速率緩升,持續>6小時(未圖示),解釋其長效保護機制。
領域突破性價值:
突破傳統終點法(亞甲基藍法)的靜態檢測局限,實現活組織原位H?S合成實時追蹤;
為氣體信號分子研究提供時間分辨工具,推動肺生理學研究向動態化發展。