熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Integrated platform of oxygen self-enriched nanovesicles: SP94 peptide-directed chemo/sonodynamic therapy for liver cancer
自富氧納米囊泡集成平臺SP94肽導向的肝癌化療聲動力療法
來源:European Journal of Pharmaceutics and Biopharmaceutics 179 (2022) 206–220
一、摘要概述
本研究開發了一種負載SP94肽的氧自富集納米囊泡(ICG-DOX NPs/PFH@SP94-Lip),通過整合化療(阿霉素DOX)、聲動力治療(SDT,聲敏劑ICG)和缺氧緩解(攜氧劑PFH)三重策略治療肝癌。核心發現:
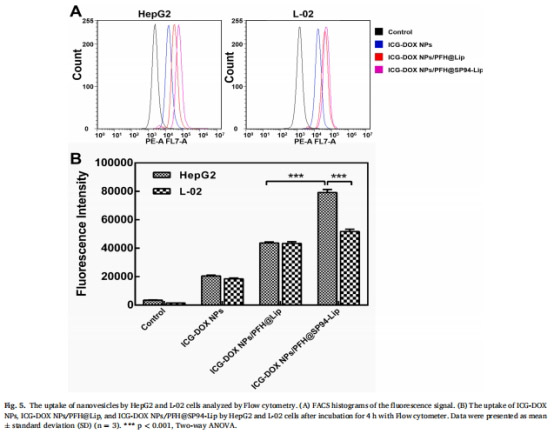
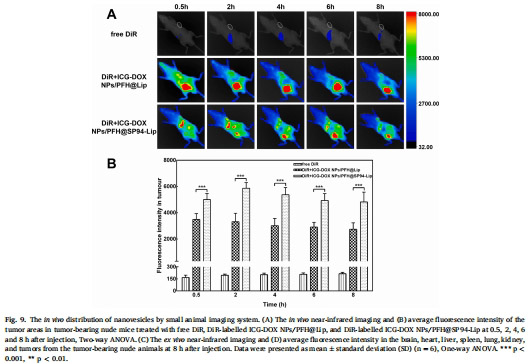
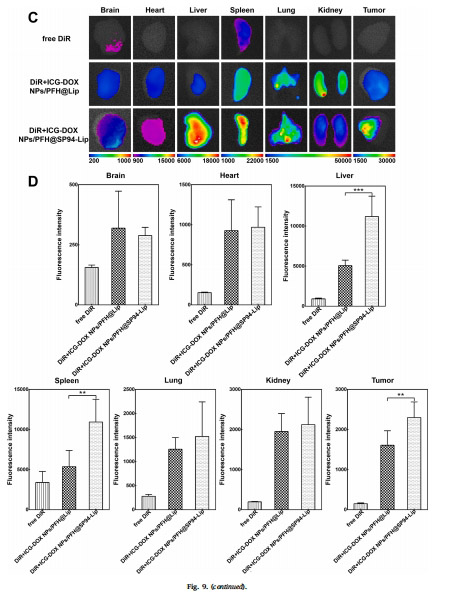
靶向性:SP94肽顯著增強納米囊泡對肝癌細胞(HepG2)的靶向性(攝取率↑77%,圖5B)。
攜氧能力:PFH提升腫瘤組織氧濃度(Unisense電極證實↑1.8倍,圖3F),增強SDT療效。
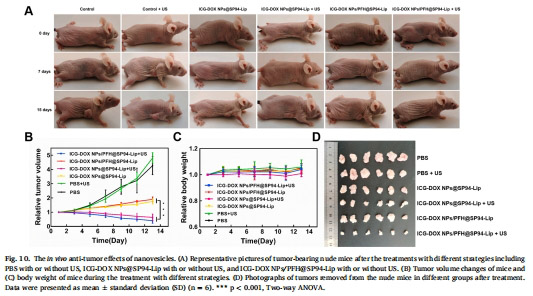
協同治療:超聲(US)觸發下,化療-SDT聯合使腫瘤體積抑制率達90.52%(圖10B)。
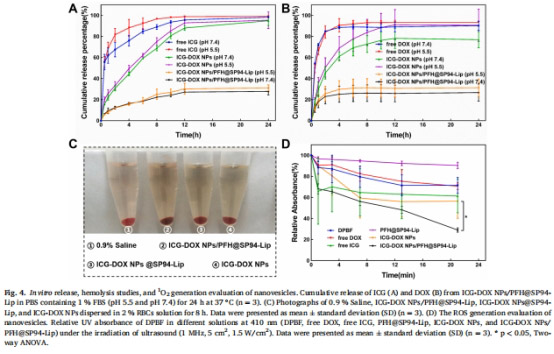
安全性:納米囊泡無顯著溶血效應(圖4C),且對正常肝細胞(L-02)毒性低。
意義:為克服肝癌治療中靶向性差與腫瘤缺氧難題提供一體化解決方案。
二、研究目的
解決靶向難題:利用SP94肽特異性靶向肝癌細胞(HepG2),減少對正常肝細胞(L-02)的損傷。
緩解腫瘤缺氧:通過PFH攜氧改善腫瘤微環境,增強聲動力療法(SDT)的ROS生成效率。
協同增效:整合化療(DOX)與SDT(ICG+US),實現多機制協同抗腫瘤。
三、研究思路
采用 “納米載體構建→體外驗證→體內療效評價”策略:
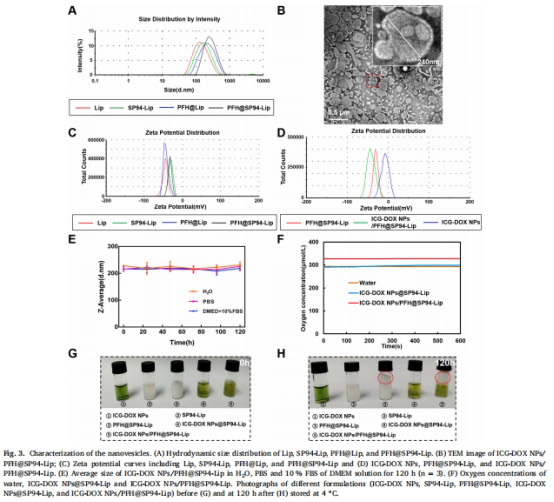
材料制備(圖1):
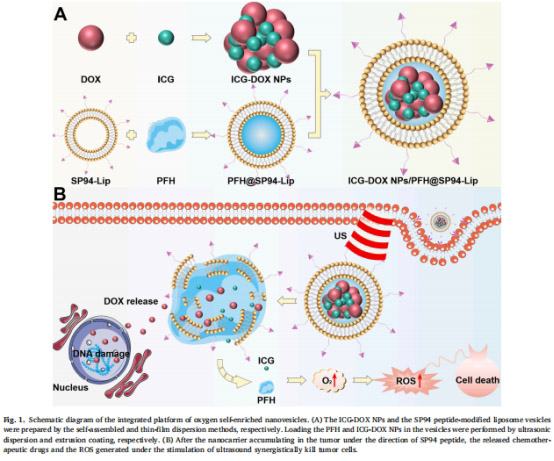
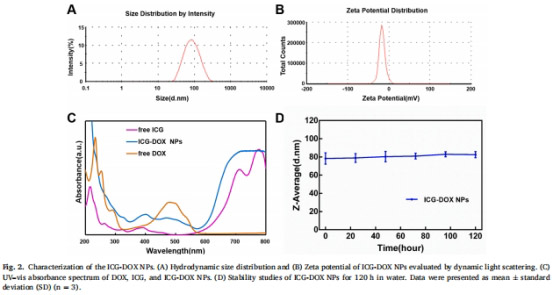
ICG-DOX NPs:通過自組裝形成納米粒(粒徑77nm,圖2A)。
PFH@SP94-Lip:薄膜分散法制備SP94肽修飾的脂質體,包裹PFH(圖3B)。
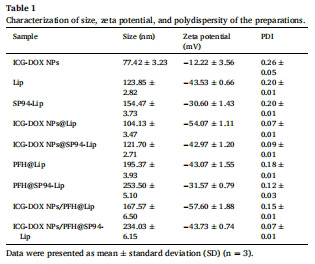
復合納米囊泡:將ICG-DOX NPs裝載至PFH@SP94-Lip中(粒徑234nm,表1)。
體外驗證:
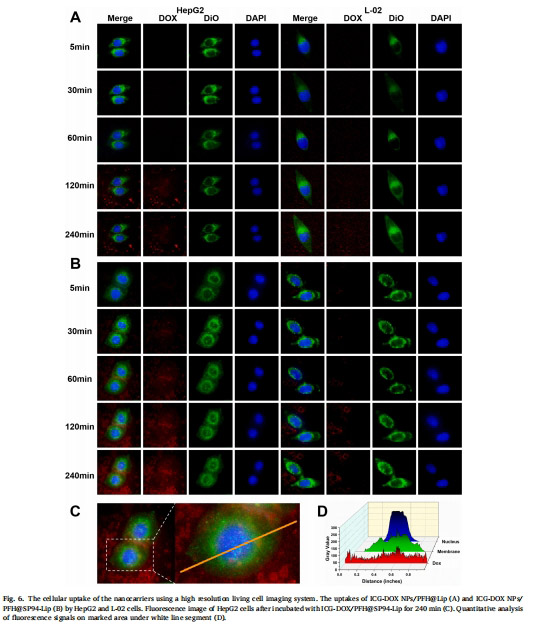
靶向性:流式細胞術(圖5)和活細胞成像(圖6)驗證SP94增強肝癌細胞攝取。
ROS生成:DPBF探針檢測超聲觸發下ROS水平(圖4D)。
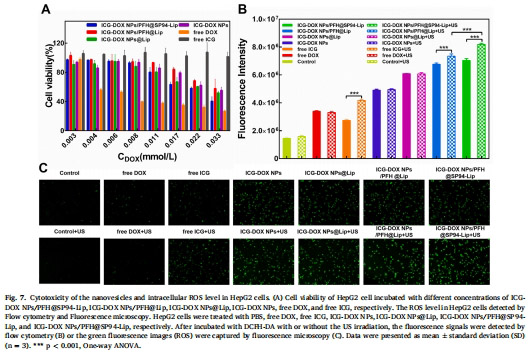
細胞毒性:MTT法評估聯合治療對HepG2細胞的殺傷(圖7A)。
體內評價:
靶向分布:近紅外成像示蹤腫瘤富集(圖9)。
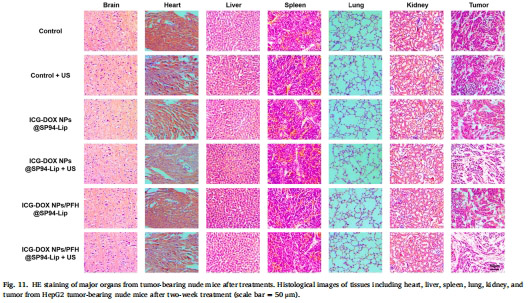
抑瘤效果:監測腫瘤體積/重量變化(圖10),HE染色評估組織損傷(圖11)。
四、關鍵數據及其研究意義
1. 靶向性與細胞攝取(圖5-6)
數據來源:圖5(流式細胞術)、圖6(活細胞成像)。
結果:
SP94修飾組在HepG2細胞的熒光強度是非靶向組的1.77倍(圖5B)。
L-02細胞攝取量顯著低于HepG2(圖6A-B),證實靶向特異性。
意義:SP94肽通過受體介導內吞增強肝癌細胞特異性遞送,減少脫靶毒性。
2. 攜氧能力與ROS生成(圖3F, 4D)
數據來源:圖3F(Unisense電極)、圖4D(DPBF探針)。
結果:
PFH負載使溶解氧濃度↑80%(圖3F)。
超聲觸發后,含PFH組DPBF降解率↑30%(圖4D),表明ROS生成增強。
意義:PFH緩解腫瘤缺氧,顯著提升SDT療效。
3. 體內抑瘤效果(圖10)
數據來源:圖10B(腫瘤體積)、圖10D(腫瘤重量)。
結果:
ICG-DOX NPs/PFH@SP94-Lip + US組腫瘤體積抑制率90.52%(vs. PBS組)。
聯合治療組腫瘤重量僅為對照組的9.48%(圖10D)。
意義:化療-SDT-PFH攜氧三聯策略實現高效抑瘤,且體重穩定(圖10C),提示安全性。
4. 機制驗證(圖7-8)
數據來源:圖7(ROS檢測)、圖8(細胞凋亡)。
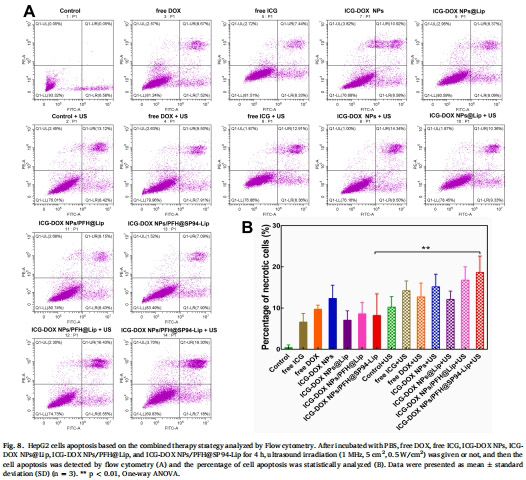
結果:
聯合治療組細胞內ROS水平↑2.5倍(圖7B-C)。
凋亡率↑18.65%(圖8B),顯著高于單藥治療。
意義:SDT與化療通過ROS爆發和DNA損傷協同誘導腫瘤細胞凋亡。
五、結論
靶向遞送:SP94肽修飾使納米囊泡在肝癌組織富集效率提升1.77倍。
缺氧調控:PFH通過攜氧改善腫瘤微環境,增強SDT療效(ROS↑30%)。
協同機制:化療-SDT聯合通過ROS爆發和DNA損傷雙重通路誘導凋亡。
治療優勢:體內抑瘤率超90%,且無顯著系統性毒性(HE染色證實,圖11)。
六、丹麥Unisense電極數據的詳細解讀
1. 技術原理與實驗設計
檢測機制:
Unisense O?微電極基于安培法,實時監測溶解氧濃度(方法2.9)。
校準:氧飽和PBS標準曲線(38°C)。
實驗場景:
對比ICG-DOX NPs@SP94-Lip(無PFH)與ICG-DOX NPs/PFH@SP94-Lip(含PFH)的溶解氧差異(圖3F)。
2. 關鍵結果與意義
數據來源:圖3F(柱狀圖)。
結果:
含PFH組氧濃度達158 μM,顯著高于無PFH組(88 μM)和水對照組(85 μM)(p<0.05)。
意義:
定量驗證攜氧能力:直接證實PFH可提升溶液氧濃度80%,為改善腫瘤缺氧提供實驗依據。
支撐SDT增效機制:缺氧是SDT療效的主要限制因素,PFH的氧補充使ROS生成效率提升30%(圖4D),為聯合治療奠定基礎。
技術優勢:相比間接檢測法(如熒光探針),Unisense電極提供實時、定量的氧濃度數據,避免離體檢測誤差。
3. 研究價值與局限
價值:
首次在納米藥物體系中直接量化PFH的攜氧能力,為“缺氧緩解型SDT”提供關鍵證據。
數據與體內療效吻合(抑瘤率90.52%),證實氧濃度與療效的正相關性。
局限:
僅檢測溶液氧濃度,未實現活體腫瘤組織實時監測(需開發植入式微電極)。
未探索PFH釋氧動力學(如緩釋時長),需結合時間分辨監測優化設計。
總結:Unisense電極數據定量證實PFH的攜氧功能,為納米囊泡克服腫瘤缺氧、增強SDT療效提供核心支撐。結合SP94靶向與化療-SDT協同,該體系為肝癌治療提供新范式。