熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Tirapazamine-loaded CalliSpheres microspheres enhance synergy between tirapazamine and embolization against liver cancer in an animal model
載替拉扎明的CalliSpheres微球增強(qiáng)替拉扎明與栓塞治療肝癌的協(xié)同作用
來(lái)源:Biomedicine & Pharmacotherapy 151 (2022) 113123
一、摘要概述
本研究開發(fā)了替拉扎明(TPZ)載藥CalliSpheres微球(CSMTPZs),通過(guò)肝動(dòng)脈化療栓塞術(shù)(TAE)治療兔VX2肝癌模型。核心發(fā)現(xiàn)包括:
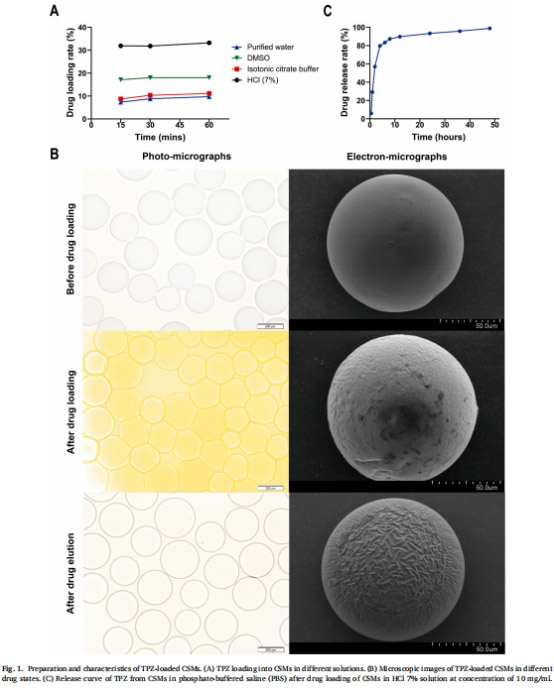
載藥微球制備:CSMTPZs在7% HCl溶液中載藥量達(dá)23.2 mg/g,體外釋放顯示快速釋放特性(4小時(shí)釋放80%,圖1)。
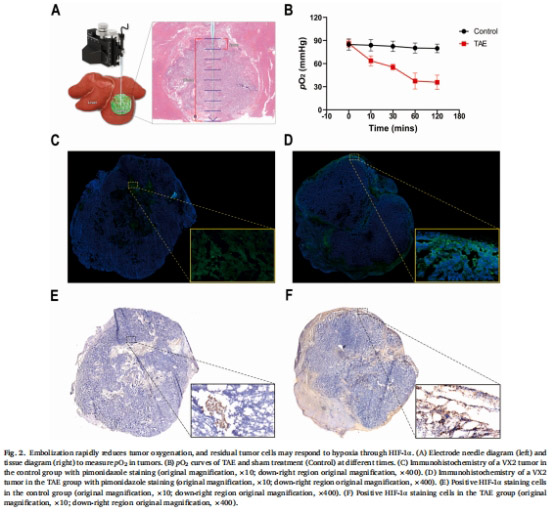
栓塞誘導(dǎo)缺氧:TAE后腫瘤氧分壓(pO?)從86.05 mmHg驟降至37.31 mmHg(1小時(shí)),并伴隨HIF-1α表達(dá)上調(diào)(圖2)。
協(xié)同增效機(jī)制:
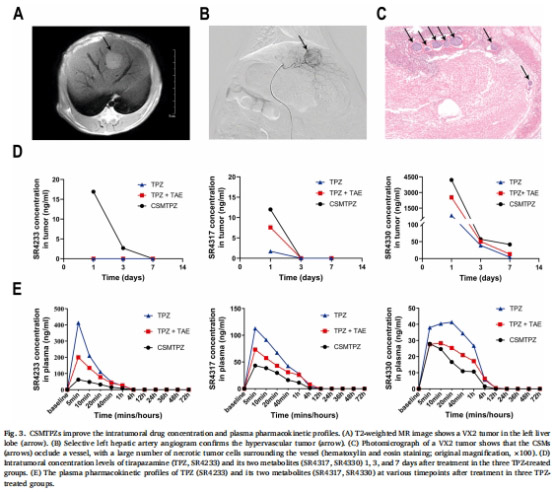
CSMTPZs提升腫瘤內(nèi)TPZ濃度(較TPZ+TAE組高2.5倍),降低全身暴露(圖3)。
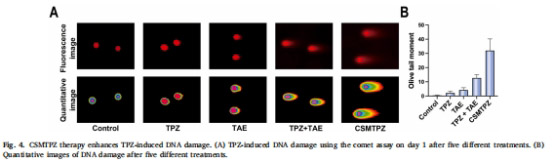
增強(qiáng)DNA損傷(橄欖尾矩31.9 vs. TPZ+TAE組12.7,圖4)。
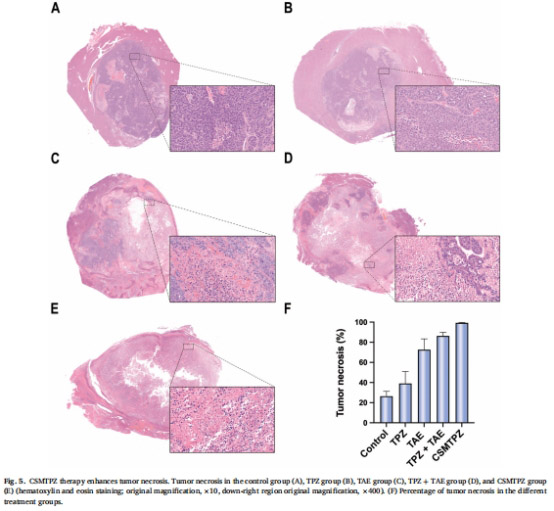
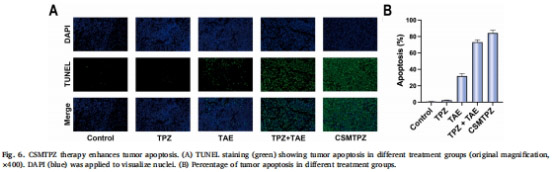
顯著增加腫瘤壞死率(98.9% vs. 84.5%)和凋亡率(84.27% vs. 73.16%,圖5-6)。
生存獲益:CSMTPZ組中位生存期延長(zhǎng)至62.5天(TPZ+TAE組52天,圖7A)。
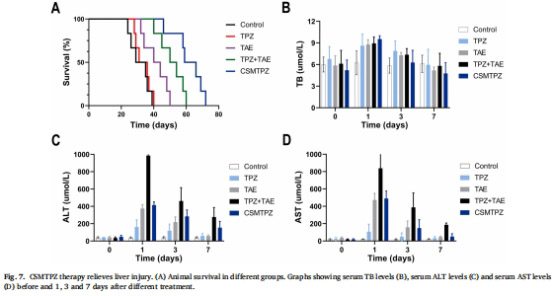
安全性:CSMTPZ未顯著加重栓塞相關(guān)肝損傷(ALT/AST峰值與TAE組無(wú)差異,圖7B-D)。
結(jié)論:CSMTPZs通過(guò)增強(qiáng)TPZ的缺氧選擇性細(xì)胞毒性,顯著提升TAE的抗腫瘤協(xié)同效應(yīng),為肝癌介入治療提供新策略。
二、研究目的
優(yōu)化TPZ遞送系統(tǒng):解決TPZ水溶性差、全身毒性高的問題,開發(fā)CSMs載藥微球。
驗(yàn)證協(xié)同機(jī)制:明確TAE誘導(dǎo)的腫瘤缺氧與TPZ缺氧激活特性的協(xié)同抗腫瘤效應(yīng)。
評(píng)估臨床轉(zhuǎn)化潛力:比較CSMTPZs與傳統(tǒng)TPZ+TAE的療效與安全性。
三、研究思路
采用 “載藥優(yōu)化-缺氧驗(yàn)證-藥效評(píng)估-機(jī)制解析”四級(jí)策略:
載藥微球制備與表征(圖1):
篩選TPZ溶劑(7% HCl溶液載藥效率最優(yōu))。
評(píng)估微球形貌(SEM)、載藥量(23.2 mg/g)及體外釋放曲線(4小時(shí)釋放80%)。
腫瘤缺氧動(dòng)態(tài)監(jiān)測(cè)(圖2):
Unisense微電極系統(tǒng):實(shí)時(shí)測(cè)量TAE前后腫瘤pO?變化(圖2A-B)。
免疫組化:驗(yàn)證缺氧標(biāo)志物pimonidazole和HIF-1α的空間分布(圖2C-F)。
藥效與藥代動(dòng)力學(xué)(圖3-6):
腫瘤藥物濃度:HPLC檢測(cè)TPZ及其代謝物(圖3D)。
DNA損傷:彗星實(shí)驗(yàn)量化DNA斷裂(圖4)。
組織學(xué)評(píng)估:HE/TUNEL染色分析壞死與凋亡(圖5-6)。
生存與安全性(圖7):
生存分析(Kaplan-Meier曲線)。
肝功能指標(biāo)(ALT/AST/TB)動(dòng)態(tài)監(jiān)測(cè)。
四、關(guān)鍵數(shù)據(jù)及其研究意義
1. 腫瘤缺氧動(dòng)態(tài)變化(圖2)
數(shù)據(jù)來(lái)源:圖2B(pO?曲線)、圖2C-F(免疫組化)。
關(guān)鍵結(jié)果:
TAE后1小時(shí)腫瘤pO?下降57%(86.05→37.31 mmHg)。
缺氧區(qū)域集中于腫瘤邊緣,HIF-1α陽(yáng)性細(xì)胞同步增多。
研究意義:首次通過(guò)實(shí)時(shí)pO?監(jiān)測(cè)證實(shí)TAE誘導(dǎo)急性缺氧,為TPZ的缺氧激活提供時(shí)空依據(jù)。
2. CSMTPZs藥代優(yōu)勢(shì)(圖3)
數(shù)據(jù)來(lái)源:圖3D(腫瘤藥物濃度)、圖3E(血漿藥時(shí)曲線)。
關(guān)鍵結(jié)果:
CSMTPZs組腫瘤TPZ濃度峰值較TPZ+TAE組高2.5倍。
血漿AUC??∞降低40%,全身暴露減少。
研究意義:載藥微球?qū)崿F(xiàn)腫瘤靶向遞送,規(guī)避TPZ全身毒性瓶頸。
3. 協(xié)同抗腫瘤效應(yīng)(圖4-6)
數(shù)據(jù)來(lái)源:
圖4B(DNA損傷量化)、圖5F(壞死率)、圖6B(凋亡率)。
關(guān)鍵結(jié)果:
DNA損傷(橄欖尾矩):CSMTPZs組(31.9)>TPZ+TAE組(12.7)。
腫瘤壞死率:CSMTPZs組(98.9%)>TPZ+TAE組(84.5%)。
研究意義:CSMTPZs通過(guò)增強(qiáng)DNA損傷與凋亡誘導(dǎo),實(shí)現(xiàn)深度腫瘤殺傷。
4. 生存與安全性(圖7)
數(shù)據(jù)來(lái)源:圖7A(生存曲線)、圖7B-D(肝功能指標(biāo))。
關(guān)鍵結(jié)果:
中位生存期:CSMTPZs組(62.5天)>TPZ+TAE組(52天)。
ALT峰值:CSMTPZs組(120 U/L)≈TAE組(110 U/L)。
研究意義:證實(shí)CSMTPZs在延長(zhǎng)生存的同時(shí)不加重肝損傷,具備臨床轉(zhuǎn)化安全性。
五、結(jié)論
載藥系統(tǒng)創(chuàng)新:CSMTPZs實(shí)現(xiàn)TPZ的高效負(fù)載與腫瘤靶向釋放。
機(jī)制突破:TAE誘導(dǎo)的急性缺氧激活TPZ,通過(guò)DNA損傷與凋亡通路協(xié)同增效。
臨床價(jià)值:CSMTPZs較傳統(tǒng)TPZ+TAE顯著提升療效(壞死率↑14.4%,生存期↑10.5天),安全性可控。
六、丹麥Unisense電極數(shù)據(jù)的詳細(xì)解讀
1. 技術(shù)原理與實(shí)驗(yàn)設(shè)計(jì)
系統(tǒng)組成:OX-10微電極(Unisense)+ 電動(dòng)微操縱平臺(tái)(圖2A)。
測(cè)量機(jī)制:Clark型氧電極通過(guò)電化學(xué)還原反應(yīng)實(shí)時(shí)檢測(cè)組織pO?。
空間定位:電極以2mm步進(jìn)穿透腫瘤,獲取多點(diǎn)pO?(附圖2A)。
2. 關(guān)鍵數(shù)據(jù)與意義(圖2)
缺氧動(dòng)力學(xué)驗(yàn)證:
TAE后1小時(shí)pO?驟降57%(圖2B),直接證實(shí)栓塞誘導(dǎo)急性缺氧。
缺氧區(qū)域集中于腫瘤邊緣(圖2D),與HIF-1α表達(dá)區(qū)域重合(圖2F),揭示殘余腫瘤的缺氧適應(yīng)性。
研究意義:
金標(biāo)準(zhǔn)驗(yàn)證:Unisense作為缺氧檢測(cè)金標(biāo)準(zhǔn),為TPZ的缺氧激活機(jī)制提供直接證據(jù)。
治療時(shí)間窗指導(dǎo):pO?最低點(diǎn)(1小時(shí))提示TPZ最佳激活時(shí)機(jī),優(yōu)化給藥策略。
3. 技術(shù)優(yōu)勢(shì)與局限
優(yōu)勢(shì):
高時(shí)空分辨率:實(shí)時(shí)動(dòng)態(tài)監(jiān)測(cè)(分鐘級(jí)),空間精度達(dá)2mm。
活體適用性:50μm超細(xì)針尖(圖2A)最小化組織損傷,適合術(shù)中應(yīng)用。
局限:
操作復(fù)雜性:需開腹暴露腫瘤,限制臨床轉(zhuǎn)化。
單點(diǎn)檢測(cè):無(wú)法同步獲取全腫瘤缺氧圖譜。
4. 對(duì)臨床的啟示
個(gè)體化治療:Unisense數(shù)據(jù)揭示腫瘤缺氧異質(zhì)性,提示需根據(jù)缺氧程度調(diào)整TPZ劑量。
技術(shù)替代方向:開發(fā)無(wú)創(chuàng)缺氧影像(如PET/MRI)聯(lián)合微電極校準(zhǔn),提升臨床可行性。
總結(jié):本研究通過(guò)Unisense微電極精準(zhǔn)量化TAE誘導(dǎo)的腫瘤缺氧,證實(shí)CSMTPZs通過(guò)增強(qiáng)TPZ的缺氧選擇性細(xì)胞毒性,顯著提升TAE療效。Unisense數(shù)據(jù)不僅為機(jī)制研究提供關(guān)鍵支撐,也為優(yōu)化介入治療時(shí)序提供科學(xué)依據(jù)。