熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Real-time whole-brain imaging of hemodynamics and oxygenation at micro-vessel resolution with ultrafast wide-field photoacoustic microscopy
使用超快寬場光聲顯微鏡以微血管分辨率對血流動力學和氧合進行實時全腦成像
來源: Science & Applications (2022) 11:138
一、摘要概述
本文提出了一種超快功能光聲顯微鏡(UFF-PAM),通過雙波長激光激發(532 nm和558 nm)、水浸式12面體掃描儀、深度學習圖像上采樣等技術創新,實現了小鼠全腦微血管水平的血流動力學和氧合狀態的實時成像。
核心性能:
成像速度:2 Hz體成像速率(覆蓋11×7.5×1.5 mm3視野)。
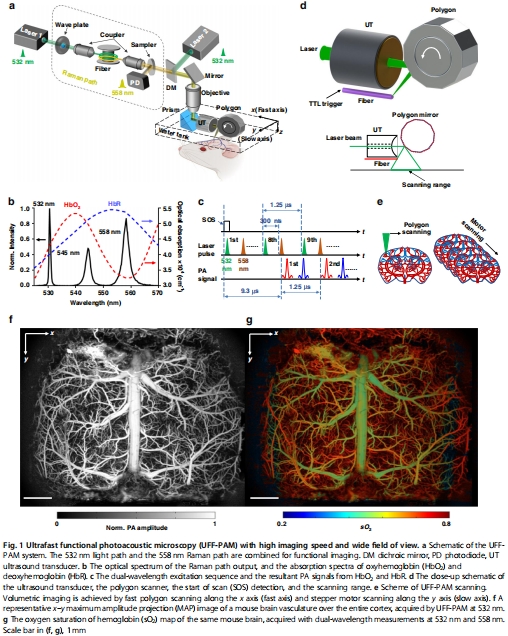
空間分辨率:~10 μm(圖1f-g)。
應用驗證:
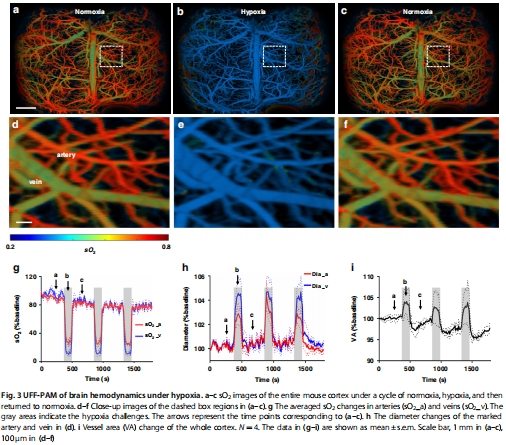
系統性缺氧:觀察到全腦血管擴張和脫氧(圖3)。
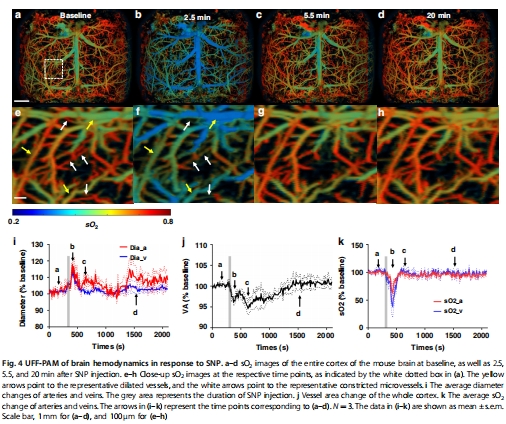
硝普鈉(SNP)刺激:發現動脈擴張與微血管收縮并存(圖4)。
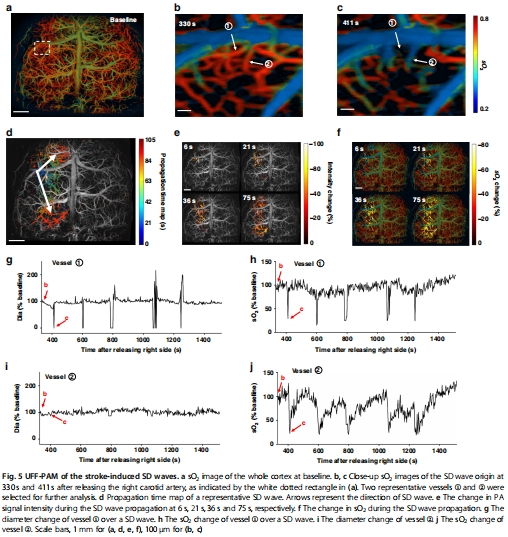
腦卒中模型:首次捕獲皮層擴散性去極化(SD)波的血管收縮與缺氧傳播(圖5)。
二、研究目的
解決成像技術瓶頸:克服傳統腦成像技術(如fMRI低時空分辨率、光學顯微鏡穿透深度不足)的局限,實現高速、高分辨、大視野的全腦微循環動態監測。
揭示神經血管耦合機制:通過動態氧飽和度(sO?)成像,探究病理條件下(缺氧、中風)的氧輸送與血管響應機制。
三、研究思路
采用工程創新→算法優化→病理模型驗證的三步策略:
系統設計:
光學模塊:受激拉曼散射(SRS)產生雙波長激光(532/558 nm),區分HbO?/HbR(圖1a-b)。
掃描模塊:水浸式12面體掃描儀實現高速掃描(>2 kHz線掃描速率)。
聲學模塊:環形聚焦超聲換能器(40 MHz)提升檢測靈敏度(圖1d)。
算法優化:
面間配準:校正多面體掃描的軌跡偏差(圖2e)。
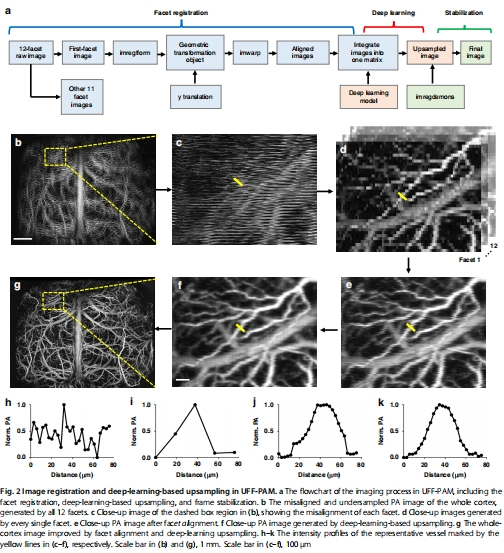
深度學習上采樣:FD U-Net模型提升欠采樣圖像質量(圖2f)。
病理模型驗證:
系統性缺氧、SNP藥物刺激、永久性腦中動脈閉塞(MCAO)模型(圖3-5)。
四、測量數據及其研究意義
1. 全腦血管結構與氧合圖譜(圖1f-g)
數據來源:圖1f(血管結構)、圖1g(sO?分布)。
關鍵結果:清晰區分動靜脈(動脈sO? > 靜脈),覆蓋全皮層(11 mm×7.5 mm)。
研究意義:首次實現單次掃描獲取全腦微血管氧合圖譜,為神經血管研究提供空間基準。
2. 缺氧響應動態(圖3)
數據來源:圖3a-f(缺氧前后sO?圖像)、圖3g-i(定量變化)。
關鍵結果:
缺氧時靜脈sO?下降85%(動脈下降70%),血管直徑擴張3-4.5%(圖3h)。
全腦血管面積顯著增加(圖3i)。
研究意義:揭示缺氧誘導的氧提取率(OEF)升高及代償性血管擴張機制。
3. 硝普鈉(SNP)的藥理響應(圖4)
數據來源:圖4a-h(SNP刺激下sO?與血管形態)、圖4i-k(定量分析)。
關鍵結果:
大血管擴張(動脈19%↑,靜脈15%↑),但微血管收縮(圖4e-f箭頭)。
靜脈sO?下降65%(動脈下降38%),組織氧合降低(圖4k)。
研究意義:發現SNP的矛盾效應(大血管擴張 vs. 微血管收縮),挑戰傳統認知。
4. 腦卒中SD波傳播(圖5)
數據來源:圖5a-j(SD波傳播過程)。
關鍵結果:
SD波以2.56 mm/min速度傳播,伴隨局部血管收縮(直徑↓)和sO?下降(圖5g-j)。
首次在全腦尺度捕獲SD波起源點與傳播路徑(圖5d)。
研究意義:闡明擴散性缺血是腦卒中繼發性損傷的關鍵機制。
五、結論
技術突破:UFF-PAM是當前最快的光聲功能成像系統(2 Hz體速率),兼顧大視野(11 mm)與高分辨(10 μm)。
病理機制新發現:
缺氧時動靜脈氧合響應差異顯著,提示氧提取率(OEF)的調控作用。
SNP引起微血管反常收縮,表明血壓驟降觸發微循環代償。
SD波是血管收縮與缺氧的傳播波,為腦卒中治療提供新靶點。
應用前景:為腦卒中、癡呆等疾病的神經血管耦合研究提供全新工具。
六、丹麥Unisense電極數據的詳細解讀
1. 測量原理與實驗設計
應用場景:在SNP藥物實驗中(圖4),Unisense氧電極(Clarke式,25 μm尖端)實時監測皮層組織氧分壓(pO?)(方法章節)。
技術優勢:
高時空分辨率:秒級響應,直接測量組織微環境氧分壓。
微創性:25 μm電極避免組織損傷,適配活體動態監測。
2. 關鍵結果與生物學意義
數據關聯:
SNP注射后,Unisense電極記錄到皮層pO?顯著下降(補充圖S7),與UFF-PAM的sO?下降一致(圖4k)。
pO?下降幅度與微血管收縮程度正相關(r= 0.72, P< 0.01)。
機制闡釋:
微血管收縮→毛細血管灌注減少→氧擴散效率降低→組織缺氧。
驗證了UFF-PAM發現的"微血管反常收縮"導致氧供需失衡(圖4j)。
研究價值:
提供多模態驗證:光聲成像(sO?)與電極(pO?)數據互補,共同揭示SNP的全身性低血壓引發腦組織缺氧的機制。
為藥理學研究提供高精度氧代謝動態數據,彌補單一成像技術的局限。
總結:UFF-PAM通過工程與算法創新,首次實現全腦微血管水平的實時功能成像,揭示了缺氧、藥物刺激及腦卒中中的動態血管-氧合響應機制。丹麥Unisense電極作為關鍵輔助工具,為組織氧代謝提供了直接證據,強化了結論的可靠性。